- 118.50 KB
- 2021-04-13 发布
难溶电解质的溶解平衡
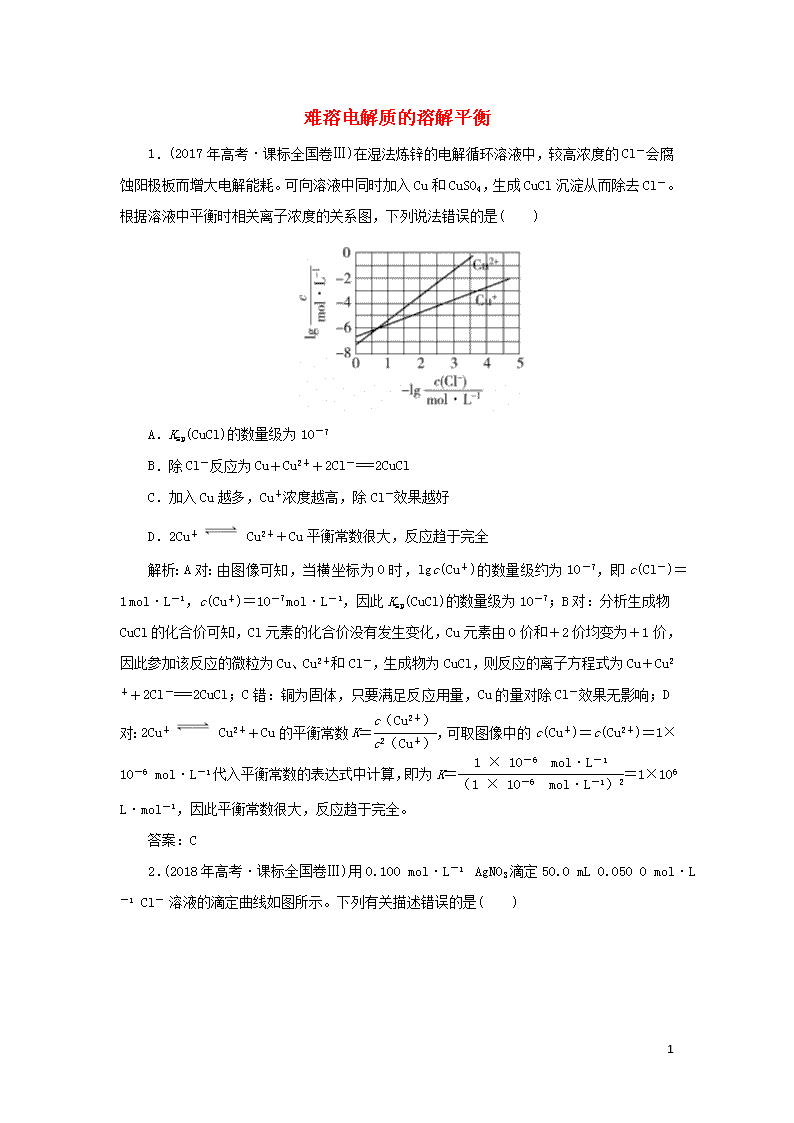
1.(2017年高考·课标全国卷Ⅲ)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
A.Ksp(CuCl)的数量级为10-7
B.除Cl-反应为Cu+Cu2++2Cl-===2CuCl
C.加入Cu越多,Cu+浓度越高,除Cl-效果越好
D.2Cu+ Cu2++Cu平衡常数很大,反应趋于完全
解析:A对:由图像可知,当横坐标为0时,lgc(Cu+)的数量级约为10-7,即c(Cl-)=1 mol·L-1,c(Cu+)=10-7 mol·L-1,因此Ksp(CuCl)的数量级为10-7;B对:分析生成物CuCl的化合价可知,Cl元素的化合价没有发生变化,Cu元素由0价和+2价均变为+1价,因此参加该反应的微粒为Cu、Cu2+和Cl-,生成物为CuCl,则反应的离子方程式为Cu+Cu2++2Cl-===2CuCl;C错:铜为固体,只要满足反应用量,Cu的量对除Cl-效果无影响;D对:2Cu+ Cu2++Cu的平衡常数K=,可取图像中的c(Cu+)=c(Cu2+)=1×10-6 mol·L-1代入平衡常数的表达式中计算,即为K==1×106 L·mol-1,因此平衡常数很大,反应趋于完全。
答案:C
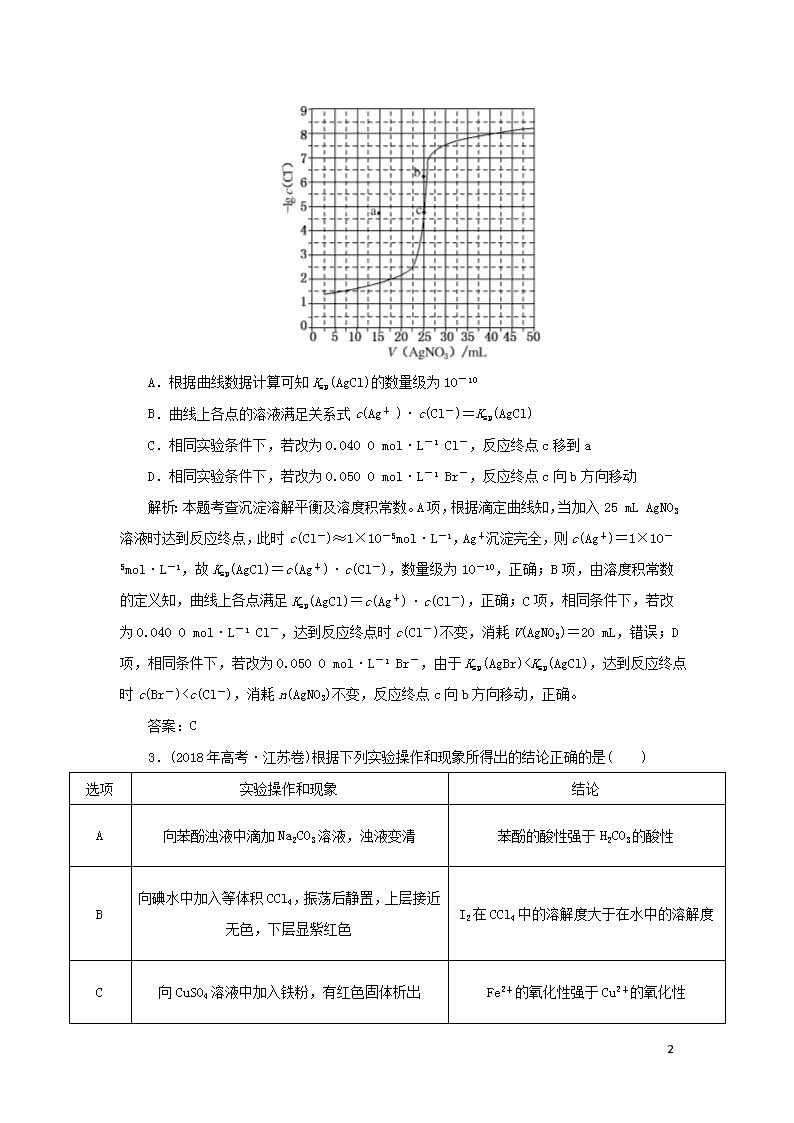
2.(2018年高考·课标全国卷Ⅲ)用0.100 mol·L-1 AgNO3滴定50.0 mL 0.050 0 mol·L-1 Cl- 溶液的滴定曲线如图所示。下列有关描述错误的是( )
4
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+ )·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.040 0 mol·L-1 Cl-,反应终点c移到a
D.相同实验条件下,若改为0.050 0 mol·L-1 Br-,反应终点c向b方向移动
解析:本题考查沉淀溶解平衡及溶度积常数。A项,根据滴定曲线知,当加入25 mL AgNO3溶液时达到反应终点,此时c(Cl-)≈1×10-5mol·L-1,Ag+沉淀完全,则c(Ag+)=1×10-5mol·L-1,故Ksp(AgCl)=c(Ag+)·c(Cl-),数量级为10-10,正确;B项,由溶度积常数的定义知,曲线上各点满足Ksp(AgCl)=c(Ag+)·c(Cl-),正确;C项,相同条件下,若改为0.040 0 mol·L-1 Cl-,达到反应终点时c(Cl-)不变,消耗V(AgNO3)=20 mL,错误;D项,相同条件下,若改为0.050 0 mol·L-1 Br-,由于Ksp(AgBr)Ksp(AgI)
解析:本题考查化学实验方案的评价。酸性:H2CO3>苯酚>HCO3-,Na2CO3溶液使苯酚浊液变澄清,是因为反应生成了HCO3-,A错误;密度:水
相关文档
- 2020_2021学年高中化学第三章水溶2021-04-13 18:49:146页
- (新课标)广西2020高考化学二轮复习 2021-04-13 14:15:189页
- 高考真题化学解析分类汇编水溶液中2021-04-13 03:26:5917页
- 高中化学选修4第三章水溶液中的离2021-04-13 02:49:3026页
- 2019-2020学年高二化学人教版选修42021-04-13 02:10:018页
- 全国版2021高考化学一轮复习章末自2021-04-12 23:44:5414页
- 2018届一轮复习人教版水溶液中的离2021-04-12 21:27:447页
- 高考化学深化复习命题热点提分专题2021-04-12 21:19:1615页
- 高中化学第三章水溶液中的离子平衡2021-04-12 20:47:478页
- 高中化学第三章水溶液中的离子平衡2021-04-12 20:43:042页