- 440.50 KB
- 2021-05-10 发布
第2讲 气体摩尔体积 阿伏加德罗定律
1.影响物质体积大小的因素
(1)在相同条件下,粒子数相同时
(2)气体粒子本身大小远小于分子间距离
2.气体摩尔体积
3.阿伏加德罗定律
(1)内容
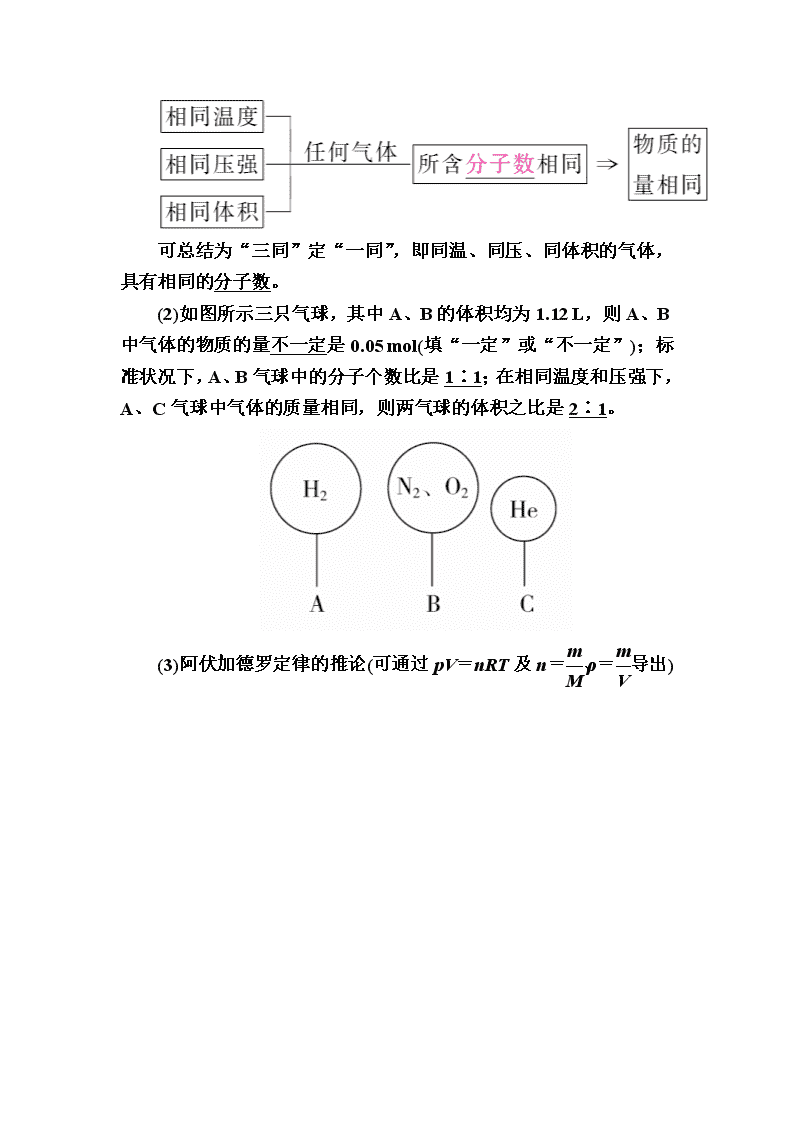
可总结为“三同”定“一同”,即同温、同压、同体积的气体,具有相同的分子数。
(2)如图所示三只气球,其中A、B的体积均为1.12 L,则A、B中气体的物质的量不一定是0.05 mol(填“一定”或“不一定”);标准状况下,A、B气球中的分子个数比是1∶1;在相同温度和压强下,A、C气球中气体的质量相同,则两气球的体积之比是2∶1。
(3)阿伏加德罗定律的推论(可通过pV=nRT及n=、ρ=导出)
1.正误判断,正确的画“√”,错误的画“×”。
(1)在标准状况下,1 mol O2与1 mol SO3的体积相同。( )
(2)在标准状况下,1 mol气体的体积约是22.4 L,在非标准状况下,1 mol气体的体积则一定不是22.4 L。( )
(3)在相同条件下,相同物质的量的CO、N2的混合气体与O2的分子个数相同,所包含的原子个数也相同。( )
(4)标准状况下,22.4 L己烷中含有的共价键数目为19NA。( )
(5)同温同压下等质量的12C18O2和16O3所含的中子数相等。( )
(6)标准状况下22.4 L的H2和NH3所含原子数目之比为1∶2。( )
答案 (1)× (2)× (3)√ (4)× (5)× (6)√
2.教材改编题
(据人教必修一P20 T4)下列各组物质中,所含分子数相同的是( )
A.2 g H2和22.4 L O2
B.常温常压下,9 g H2O和0.5 mol Br2
C.11 g CO2和4.48 L N2(标准状况)
D.2.24 L CCl4(标准状况)和0.1 mol NH3(标准状况)
答案 B
解析 物质的质量、物质的量、微粒个数不受温度、压强的影响。
考点1 气体摩尔体积
典例1 下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L
②0.5 mol H2所占体积为11.2 L ③标准状况下,1 mol H2O的体积为22.4 L ④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L ⑤各种气体的气体摩尔体积都约为22.4 L·mol-1 ⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤ B.④⑥ C.③④⑥ D.①④⑥
解析 ①物质不一定是气体;②不一定在标准状况下;③水在标准状况下不是气体;⑤气体摩尔体积与温度、压强有关。
答案 B
名师精讲
1.气体摩尔体积的解题思路
⇒⇒⇒
2.应用气体摩尔体积时应注意的四点
(1)适用“条件”:一般指标准状况,即0 ℃、1.01×105 Pa。
(2)适用对象:必须是气体物质,可以是单一气体,也可以是混合气体。水、酒精、SO3、CCl4、苯、己烷等物质在标准状况下不是气体。
(3)在标准状况下,气体摩尔体积约为22.4 L·mol-1。
(4)22.4 L气体,在标准状况下是1 mol,在非标准状况下,可能是1 mol,也可能不是1 mol。
1.下列两种气体的分子数一定相等的是( )
A.质量相等、密度不同的N2和C2H4
B.体积相等的CO和N2
C.等温、等体积的O2和N2
D.等压、等体积的N2和CH4
答案 A
解析 A项,由n=,M(N2)=M(C2H4)=28 g/mol,故等质量的N2和C2H4分子数相等;B项,温度压强不确定,故等体积的CO和N2物质的量不确定;由阿伏加德罗定律,“三同”才能定“一同”,故C、D两项错误。
2.设NA为阿伏加德罗常数的值,如果a g某气态双原子分子的分子数为p,则b g该气体在标准状况下的体积V(L)是( )
A. B. C. D.
答案 D
解析 解法一:公式法
a g双原子分子的物质的量为 mol,该双原子分子的摩尔质量为= g·mol-1,所以b g气体在标准状况下的体积为×22.4 L·mol-1= L。
解法二:比例法
同种气体其分子数与质量成正比,设b g气体的分子数为N
a g~p
b g~N
则:N=,双原子分子的物质的量为,所以b g该气体在标准状况下的体积为 L。
考点2 阿伏加德罗定律
典例2 下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.体积相等时密度相等
B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等
D.质量相等时具有的质子数相等
解析 依据阿伏加德罗定律:在同温同压下的两种气体体积相同,分子数相同,而 12C18O和 14N2分子中所含电子数相同,C正确。同温同压同体积条件下密度之比等于其摩尔质量之比, 12C18O的摩尔质量为30 g·mol-1,14N2 的摩尔质量为28 g·mol-1,A错误;1个 12C18O分子中所含中子数为16,1个14N2分子中所含中子数为14,B错误; 12C18O和 14N2分子中所含质子数相同,n=,m相同、M不同,n不同,故等质量的两种气体所具有的质子数不同,D错误。
答案 C
名师精讲
阿伏加德罗定律理解
(1)阿伏加德罗定律适用于任何气体(包括混合气体)。
(2)气体体积主要受温度和压强的影响。
(3)同温、同压、同体积、同分子数,这“四同”相互制约,只要其中“三同”成立,第“四同”也成立,即“三同”定“一同”。
(4)应用阿伏加德罗定律及推论时不宜死记硬背,要熟记相关化学计量的定义式,并结合相互关系进行推导。
3.如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )
A.所含原子数相等 B.气体密度相等
C.气体质量相等 D.摩尔质量相等
答案 A
解析 左瓶与右瓶中气体的物质的量相等,N2、O2分子均为双原子分子,A正确;N2、O2的比例不固定,气体的质量不一定相等,密度不一定相等;当N2与O2的物质的量相等时,摩尔质量相等,其余情况摩尔质量不相等。
4.等温等压下,有质子数相等的CO、N2、C2H2三种气体,下列叙述中正确的是( )
A.体积之比为13∶13∶14 B.密度之比为14∶14∶13
C.质量之比为1∶1∶1 D.原子数之比为1∶1∶1
答案 B
解析 三种气体分子的质子数分别为14、14、14,质子数相等的CO、N2、C2H2三种气体,物质的量相等,等温等压下,气体的体积与其物质的量成正比,所以三者体积之比为1∶1∶1,A错误;CO、N2、C2H2摩尔质量分别为28 g·mol-1、28 g·mol-1、26 g·mol-1,等温等压下,气体摩尔体积相同,根据ρ==知,密度与摩尔质量成正比,则密度之比为28∶28∶26=14∶14∶13,B正确;三种气体分子的物质的量相等,CO、N2、C2H2摩尔质量分别为28 g·mol-1、28 g·mol-1、26 g·mol-1,根据m=nM
知:质量之比与摩尔质量成正比为28∶28∶26=14∶14∶13,C错误;1分子CO、N2、C2H2分别含原子数为2、2、4,所以三种气体原子数之比为1∶1∶2,D错误。
微专题 气体体积的测量及读数
答题模板
(1)将××××恢复至室温。(2)调节×××与×××两端液面相平。(3)视线与×××在同一水平线上。
典例 (2017·河北定州模拟)某同学设计如下图所示装置分别进行如下实验探究(夹持装置已略去),请回答下列问题:
实验
药品
制取气体
量气管中液体
Ⅰ
Cu、稀HNO3
NO
H2O
Ⅱ
镁铝合金、NaOH溶液
H2
H2O
本实验应对量气管多次读数,读数时应注意:_____________________________________________________。
抽样评析
抽样试卷
①使量气管与干燥管两端液面相平
②视线与凹液面相切
分析点评
①气体的体积受温度影响较大,读数时应将气体冷却至室温后再读数
②“相切”表达语意不准确,仰视、俯视的情况下,视线都能与凹液面相切
规范答案
将实验装置恢复到室温,调节量气管与干燥管两端液面相平,视线与凹液面最低处在同一水平线上
踩点得分 解答此类题目要注意的得分点是:
(1)将加热后的仪器装置恢复至室温。(2)调节量气管,使两端液面相平。(3)读数时视线与凹液面最低处在同一水平线上。
(建议用时:40分钟)
一、选择题(每题6分,共48分)
1.(2017·潍坊质检)下列说法正确的是( )
A.1 mol任何气体的气体摩尔体积都约为22.4 L·mol-1
B.20 ℃、1.0×105 Pa时,同体积的O2与CO2含有相同的分子数
C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况
D.2 mol气体的体积约为44.8 L
答案 B
解析 没有给出气体所处的温度和压强,标准状况下气体摩尔体积约为22.4 L·mol-1,A错误;根据阿伏加德罗定律,同温、同压下,同体积的任何气体都含有相同的分子数,B正确;1 mol气态物质在非标准状况时,体积也有可能等于22.4 L,C错误;没有给出气体所处的温度和压强,D错误。
2.下列有关C2H2和C6H6的叙述错误的是( )
A.二者的碳元素的质量分数相同
B.在标准状况下,等体积的两种物质含有的分子数相等
C.等物质的量时,二者质量之比为=
D.等质量时,二者完全燃烧消耗相同状况下的氧气体积相等
答案 B
解析 C2H2与C6H6的最简式均为CH,故二者的碳元素的质量分数相同,A正确;标准状况下,C6H6为非气体,等体积的两种物质的物质的量不相等,所以含有的分子数也不相等,B错误;假设二者均为1 mol,则C2H2的质量为26 g,C6H6的质量为78 g,质量之比==,C正确;假设二者质量均为78 g,则C2H2为3 mol,C6H6为1 mol,3 mol C2H2完全燃烧消耗7.5 mol O2,1 mol C6H6完全燃烧也消耗7.5 mol O2,D正确。
3.如图所示,①和②为两个体积相同的固定容器,图中“”和“”分别表示氢原子和氧原子,则下列说法正确的是( )
A.若①中的H2为1 mol,则②中所含原子总数为3.01×1023个
B.①和②中气体的质量之比为1∶8
C.H2、O2均能发生化合反应,但不能发生置换反应
D.两容器的温度和压强均相同
答案 B
解析 根据图示可知,①和②中H2与O2的分子个数之比为2∶1,若H2为1 mol,则O2为0.5 mol,故O原子数目为6.02×1023个,A错误;①和②中H2与O2的分子个数之比为2∶1
,所以其物质的量之比为2∶1,质量之比为1∶8,B正确;H2能发生置换反应,如H2与CuO反应,O2也能发生置换反应,如O2与H2S反应,C错误;根据阿伏加德罗定律,①和②两容器体积相同,但气体分子个数不同,所以两容器的温度和压强不可能均相同,D错误。
4.下列与阿伏加德罗常数有关的说法正确的是( )
A.NA个Fe(OH)3胶体粒子的质量为107 g
B.8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA
C.标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA
D.2.3 g Na与氧气完全反应,反应中转移的电子数在0.1NA~0.2NA之间
答案 B
解析 Fe(OH)3胶体粒子是许多Fe(OH)3微粒的聚合体,NA个Fe(OH)3胶体粒子的质量远大于107 g,A错误;Cu2S和CuO中铜的质量分数相同,计算可知,B正确;氯气溶于水只有部分与水反应,C错误;反应中每个钠原子失去1个电子,故2.3 g Na与氧气完全反应,反应中转移的电子数为0.1NA,D错误。
5.利用太阳能分解水制氢,若光解0.02 mol水,下列说法正确的是( )
A.可生成H2的质量为0.02 g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224 L(标准状况)
D.生成H2的量理论上等于0.04 mol Na与水反应产生H2的量
答案 D
解析 根据方程式2H2O===2H2↑+O2↑,光解0.02 mol H2O,可产生0.02 mol H2和0.01 mol O2,则得:可生成H2的质量为0.02 mol×2 g/mol=0.04 g,故A错误;可生成氢的原子数为0.02 mol×2×6.02×1023 mol-1=2.408×1022,故B错误;可生成标准状况下H2的体积为0.02 mol×22.4 L/mol=0.448 L,故C错误;钠与H2O
反应发生2Na+2H2O===2NaOH+H2↑,则0.04 mol Na与H2O反应生成0.02 mol H2,故D正确。
6.如图所示,在同温同压下,分别用氯化氢和四种混合气体吹出体积相等的五个气球。A、B、C、D四个气球中,与充有氯化氢的气球所含原子数一定相等的是( )
答案 C
解析 同温同压下,体积相等的气球中,气体的物质的量相等。HCl是双原子分子,因此混合气体分子的平均原子数一定等于2时才符合要求。A项中有可能等于2,B项中一定大于2,C项中一定等于2,D项中一定大于2,故选C。
7.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.10 ℃时,pH=1.0的1 L H2SO4溶液中含H+的数目为0.1NA
B.常温下,14 g 14C含中子的数目为6NA
C.标准状况下,11.2 L NO与11.2 L O2混合后,气体中所含原子总数小于2NA
D.0.1 mol苯乙烯含碳碳双键的数目为0.4NA
答案 A
解析 10 ℃时,pH=1.0的1 L H2SO4溶液中含H+的物质的量为0.1 mol,即含H+的数目为0.1NA,A正确。常温下,14 g 14C的物质的量为1 mol,含中子数目为(14-6) mol×NA mol-1=8NA,B错误;标准状况下,11.2 L NO的原子总数为NA,11.2 L O2的原子总数为NA,根据原子守恒,气体混合前后原子总数不变,都为2NA,故C错误;苯环中不含碳碳双键,所以0.1 mol苯乙烯含碳碳双键的数目为0.1NA,D错误。
8.设NA表示阿伏加德罗常数。下列说法中错误的是( )
A.标准状况下,22.4 L由H2和O2组成的混合气体所含分子总数为NA
B.1 mol Cl2参加反应,转移的电子数一定为2NA
C.常温常压下,1 mol氖气含有的原子数为NA
D.1 L 1 mol·L-1 FeCl3溶液中Fe3+的数目小于NA
答案 B
解析 标准状况下,22.4 L由H2和O2组成的混合气体的物质的量为=1 mol,所含分子总数为NA,故A正确;1 mol Cl2参加反应,若与氢氧化钠溶液反应,1 mol氯气完全反应转移了1 mol电子,转移的电子数为NA,故B错误;常温常压下,1 mol氖气含有1 mol原子,含有氖原子数为NA,故C正确;1 L 1 mol·L-1 FeCl3溶液中含有氯化铁的物质的量为1 mol·L-1×1 L=1 mol,由于铁离子部分水解,则溶液中Fe3+的数目小于NA,故D正确。
二、非选择题(共52分)
9.(10分)臭氧比氧气具有更强的氧化性,可用氧气通过高压放电管来制取臭氧:3O22O3。
(1)若上述反应的转化率为30%,所得混合气的平均摩尔质量为________(保留一位小数),若上述反应的转化率增至40%,则混合气的平均摩尔质量________(填“增大”“不变”或“减小”)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g,则原混合气中臭氧的体积分数为_______。
答案 (1)35.6 g·mol-1 增大 (2)3 (3)50%
解析 (1)假设有1 mol O2,反应的转化率为30%,发生反应的O2为1 mol×30%=0.3 mol,则:
3O2 2O3
3 2
0.3 mol 0.2 mol
故反应后所得气体为0.2 mol O3和0.7 mol O2,平均摩尔质量
M=≈35.6 g·mol-1;反应正向进行,混合气体的质量不变,总物质的量减小,所以平均摩尔质量增大。
(2)3O22O3 ΔV
2 1
V(O3) (8-6.5) L=1.5 L
解得:V(O3)=2×1.5 L=3 L。
(3)n==0.04 mol,反应后固体质量增重21.6 g-20 g=1.6 g,气体全部参与反应。
设氧气、臭氧的物质的量分别为x mol、y mol,
则,得
故臭氧的体积分数为×100%=50%。
10.(12分)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:
(1)混合气体的密度是________________。
(2)混合气体的平均摩尔质量是________________。
(3)CO2和CO的体积之比是________________。
(4)CO的体积分数是________________。
(5)CO2和CO的质量之比是________________。
(6)CO的质量分数是________________。
(7)混合气体中所含氧原子的物质的量是________。
(8)混合气体中所含碳原子的物质的量是________。
答案 (1)1.339 g·L-1 (2)30 g·mol-1 (3)1∶7 (4)87.5% (5)11∶49 (6)81.7% (7)0.5625 mol (8)0.5 mol
解析 (1)ρ==≈1.339 g·L-1。
(2)解法一:n==0.5 mol,
M===30 g·mol-1。
解法二:M=ρ·Vm=1.339 g·L-1×22.4 L·mol-1≈30 g·mol-1。
(3)根据阿伏加德罗定律:体积之比=物质的量之比,最简单的方法是用十字交叉法计算:
(4)CO的体积分数=CO的物质的量分数=×100%=87.5%。
(5)===11∶49。
(6)CO的质量分数=×100%≈81.7%。
(7)n(O)=2n(CO2)+n(CO)=2×0.5 mol×+0.5 mol×=0.5625 mol。
(8)n(C)=n(CO2)+n(CO)=0.5 mol。
11.(10分)(1)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g,则两种气体的物质的量之和为________mol,其中CO2为________mol,CO占总体积的________%。
(2)在某温度时,一定量的元素A的氢化物AH3,在恒温恒压的密闭容器中完全分解为两种气态单质,此时容器的体积变为原来的,则
A单质的分子式为____________,此分解反应的化学方程式为_________________________________________________________。
答案 (1)1.75 0.75 57.1
(2)A4 4AH3===A4+6H2
解析 (1)任何气体在标准状况下的摩尔体积都是22.4 L·mol-1,所以,题中两气体的物质的量之和为=1.75 mol。设混合气体中CO的物质的量为x,CO2的物质的量为y,则有:x+y=1.75 mol,28 g·mol-1·x+44 g·mol-1·y=61 g,解得:x=1 mol,y=0.75 mol。CO的体积分数即为物质的量分数,即×100%=57.1%。
(2)容器的体积变为原来的,所以气体分子数也为原来的,A的氢化物AH3完全分解为两种气态单质,其中一种必然为H2,另一种设为Ax,根据反应前后原子守恒可得到答案。
12.(10分)现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量:________。
(2)混合气体中碳原子的个数:________。(用NA表示阿伏加德罗常数的值)
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:________;
②标况下气球中收集到的气体的体积为________;
③气球中收集到的气体的电子总数为________。(用NA表示阿伏加德罗常数的值)
答案 (1)36 g·mol-1 (2)0.4NA
(3)①28 g·mol-1 ②4.48 L ③2.8NA
解析 (1)混合气体的体积为8.96 L,则其物质的量为n===0.4 mol,混合气体的平均摩尔质量为=36 g·mol-1。
(2)设混合气体中CO的物质的量为x,CO2的物质的量为y,则根据混合物的质量为14.4 g可得:28x+44y=14.4①;根据气体的物质的量为0.4 mol,所得x+y=0.4②;解①②得:x=0.2 mol,y=0.2 mol;由于CO和CO2中均含1个碳原子,故0.2 mol CO和0.2 mol CO2中共含0.4 mol C原子即0.4NA个。
(3)将混合气体依次通过图中装置,则CO2会被NaOH溶液吸收,剩余CO,被浓硫酸干燥后,则在气球中收集到的是干燥纯净的CO气体;①气球中收集到的气体为CO,而一种物质的摩尔质量在数值上等于该物质的相对分子质量,故收集到的气体的摩尔质量为28 g·mol-1;②气球中的气体为CO,其体积V=nVm=0.2 mol×22.4 L·mol-1=4.48 L;③一个CO含有14个电子,由(2)求出的CO的物质的量为0.2 mol,则电子的物质的量为0.2 mol×14=2.8 mol,电子总数为2.8NA个。
13.(10分)某液体化合物X2Y4,常用做火箭燃料。16 g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)===X2(g)+2Y2O(l)。冷却后标准状况下测得气体生成物的体积为11.2 L,其密度为1.25 g/L,则:
(1)反应前O2的体积V(O2)为________。
(2)X2的摩尔质量为________;Y元素的名称是____________。
(3)若反应生成0.1 mol X2,则转移电子的物质的量为________mol。
答案 (1)11.2 L (2)28 g/mol 氢 (3)0.4
解析 (1)根据化学方程式,参加反应的O2与生成的X2的物质的量相等。根据阿伏加德罗定律,则参加反应的O2也为11.2 L。
(2)生成的X2的质量为11.2 L×1.25 g/L=14 g,故X2的摩尔质量为14 g÷0.5 mol=28 g/mol,参加反应的X2Y4与O2的物质的量相等,均为0.5 mol,则X2Y4的摩尔质量为=32 g/mol,故Y为氢元素。
(3)由化学方程式可知每生成1 mol X2转移4 mol e-,则生成0.1 mol X2转移电子0.4 mol。
相关文档
- 2020届高考化学一轮复习化学计量在2021-05-10 21:04:0311页
- 2020届高考化学一轮复习化学反应与2021-05-10 20:34:198页
- 通用版高考化学微一轮复习化学平衡2021-05-10 19:28:2915页
- 2020届高考化学一轮复习化学反应中2021-05-10 18:37:199页
- 2020届高考化学一轮复习化学实验常2021-05-10 18:22:1928页
- 2021届(鲁科版)高考化学一轮复习化学2021-05-10 17:29:498页
- 2020届高考化学一轮复习化学反应与2021-05-10 14:29:1621页
- 2021届高考化学一轮复习化学实验方2021-05-09 00:28:2313页
- 2020届高考化学一轮复习化学反应速2021-05-08 22:36:5015页
- 2020届高考化学一轮复习化学反应与2021-05-08 22:26:4710页