- 897.79 KB
- 2021-05-09 发布
考点一 氯及其化合物的性质
考点清单
考点基础
一、氯元素的位、构、性关系
1.氯元素位于元素周期表中①
第三
周期②
第ⅦA
族,其原子结构
示意图为
。氯原子易得到一个电子形成氯离子(
),
因此,氯元素具有较强的非金属性,在自然界中以化合态形式存在。氯气具
有③
强氧化
性,化学性质活泼,以得电子发生还原反应为主。
2.氯气的性质
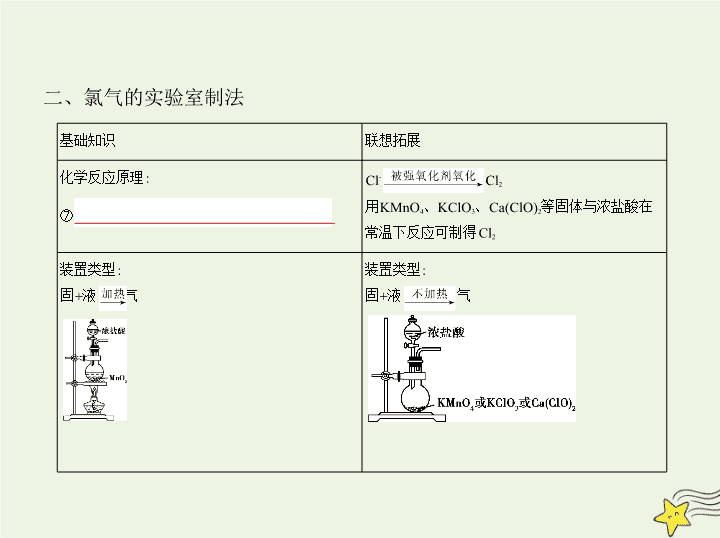
二、氯气的实验室制法
基础知识
联想拓展
化学反应原理:
⑦
MnO
2
+4HCl(浓)
MnCl
2
+Cl
2
↑+2H
2
O
Cl
-
Cl
2
用KMnO
4
、KClO
3
、Ca(ClO)
2
等固体与浓盐酸在
常温下反应可制得Cl
2
装置类型:
固+液
气
装置类型:
固+液
气
收集方法:
向上排空气法或排饱和食盐水法
收集方法的选择与气体的密度、溶解性及其在
空气中的稳定性等有关
尾气吸收:Cl
2
有毒,常用⑧
NaOH溶液
吸收尾
气,防止污染环境
根据有害气体的性质,常设置点燃转化、试剂吸
收等处理装置
说明
Cl
2
中的HCl(g)可用饱和食盐水吸收
,H
2
O(g)可用浓硫酸吸收。
重点突破
一、氯水成分的复杂性和性质的多样性
1.反应原理及成分
Cl
2
+H
2
O
H
+
+Cl
-
+HClO
HClO
H
+
+ClO
-
2HClO
2HCl+O
2
↑
新制氯水中,存在的分子有Cl
2
、H
2
O、HClO,离子有H
+
、Cl
-
、ClO
-
、OH
-
。
长时间放置的氯水变质转化为稀盐酸。
2.氯水的性质
氯水在与不同物质发生反应时,表现出成分的复杂性和性质的多样性。
说明 (1)氯水通常密封保存于棕色试剂瓶中(见光易分解的物质均保存在
棕色试剂瓶中);
(2)Cl
2
能使湿润的蓝色石蕊试纸先变红,后褪色。
二、次氯酸、氯气、活性炭、SO
2
和Na
2
O
2
漂白性的区别
次氯酸漂白是利用次氯酸的强氧化性,把有机色素氧化成无色物质,属于化
学变化,具有不可逆性、彻底性。次氯酸漂白的对象是有机色素,不能漂白
无机离子如Fe
3+
、Cu
2+
等。
氯气漂白的实质是次氯酸的漂白,干燥的氯气不具有漂白性。如Cl
2
只能使
湿润的有色布条褪色,因为氯气和水反应生成次氯酸,次氯酸具有漂白性。
这个性质常用于检验氯气。
活性炭漂白是利用活性炭的吸附作用,是一种物理漂白。
SO
2
漂白是由于它能跟某些有色物质反应生成不稳定的无色物质。
注意 SO
2
只能使紫色石蕊试液变红,而不能使其褪色。
Na
2
O
2
具有漂白性是因为过氧化钠有极强的氧化性,能把有机色素氧化成
无色物质。
考点二 卤素性质的相似性和递变性 海水资源的开发利用
考点基础
一、卤素性质的相似性和递变性
1.相似性
(1)都能与大多数金属反应,如2Fe+3Br
2
2FeBr
3
(I
2
与Fe反应生成①
FeI
2
)
;
(2)都能与H
2
反应:H
2
+X
2
2HX;
(3)都能与H
2
O反应:X
2
+H
2
O
HX+HXO(F
2
与H
2
O的反应为
2F
2
+2H
2
O
4HF+O
2
)
;
(4)都能与碱液反应(F
2
除外),如Cl
2
+2NaOH
NaCl+NaClO+H
2
O。
2.递变性
F
2
Cl
2
Br
2
I
2
颜色:
颜色加深
熔、沸点:
逐渐升高
密度:
逐渐增大
水溶性:
逐渐减小
氧化性:
逐渐减弱
还原性(X
-
):
逐渐增强
注意 根据相似相溶原理,Br
2
、I
2
在水中溶解度小,而易溶于酒精、苯、四
氯化碳等有机溶剂。
对于在溶液中生成Br
2
、I
2
的反应,常加入苯或四氯化
碳,通过有机层的颜色来加以确认
。
3.特殊性
氟元素无正价
,F
2
与H
2
O发生置换反应生成O
2
,F
2
可与Xe、Kr等稀有气体反
应生成氟化物。
②
Br
2
是
常温下唯一呈液态的非金属单质
;液溴易挥发且有毒,通常用
③
水
液封来保存。
I
2
易升华,淀粉溶液遇I
2
变蓝
。
Br
2
和I
2
都可被某些有机溶剂(如四氯化碳、汽油)萃取。
I
2
易与Na
2
S
2
O
3
溶液反应:I
2
+2S
2
2I
-
+S
4
,用于通过滴定(以④
淀粉
溶液
为指示剂)来定量测定碘的含量。
二、海水资源的开发利用
重点突破
1.海水中提溴(Br
2
)
(1)先用蒸馏法将海水浓缩,再用硫酸将浓缩的海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。
2NaBr+Cl
2
Br
2
+2NaCl
(3)向含溴单质的水溶液中通入热空气或水蒸气吹出溴蒸气,使溴蒸气与二
氧化硫在吸收塔内作用以达到富集的目的。
Br
2
+SO
2
+2H
2
O
2HBr+H
2
SO
4
(4)向吸收塔内的溶液中通入适量的氯气。
2HBr+Cl
2
2HCl+Br
2
(5)用四氯化碳(或苯)萃取吸收塔内溶液中的溴单质。
2.海水中提碘(I
2
)
虽然海水中碘的总蕴藏量很大,但由于其浓度很低,故目前工业生产中碘的
获得并不是直接从海水中提取。因为海洋中的某些植物具有富集碘的能
力,如海带等,所以从海带等海产品中提取碘是工业上获取碘的重要途径。
从海带中提取碘的流程图如下:
灼烧 水 氧化剂
干海带→海带灰→浸泡液
滤液
碘的四氯化碳溶液
碘单
质
常用的氧化剂有Cl
2
、H
2
O
2
、MnO
2
等。
方法 卤素离子的检验方法
1.AgNO
3
溶液—沉淀法
未知液
2.置换—萃取法
未知液
有机层呈
方法技巧
3.氧化—淀粉法检验I
-
未知液
蓝色溶液,表明有I
-
例 (2019湖北石首一中一调,16)用下面的方案进行某些离子的检验,其中
方案设计严密的是
( )
A.检验试液中的S
:试液
无沉淀
白色沉淀
B.检验试液中的S
:试液
气体
褪色
C.检验试液中的I
-
:试液
棕黄色溶液
蓝色溶液
D.检验试液中的C
:试液
白色沉淀
沉淀
溶解
考虑所加试剂的性质;考虑离子的干扰。
解题导引
解析 A项,Ag
+
、S
均干扰S
的检验;B项,HS
、ClO
-
均干扰S
的
检验;D项,S
干扰C
的检验;C项,H
2
O
2
将I
-
氧化为I
2
,碘水呈棕黄色,淀粉
遇I
2
会变蓝;A、B、D均不严密,C严密。
答案 C