- 255.00 KB
- 2021-05-08 发布
高二化学考试
第I卷(选择题共50分)
_、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题章)
1. 化学与生活、生产密切相关,下列食品添加剂中,其使用目的与反应速率有关的是、
A.抗氧化剂 B.调味剂 C.营养强化剂 D.着色剂
2. 在一定条件下,对于反应A2(g) + 3B2 (g) ——2AB3 (g)来说,下列化学反应速率的表示中最慢的是
A. p(A2)=0. 8 mol ・ I.t ・ s-1 B. v( A2) =30 mol • L 1 • min-1
C. Z?(AB3) = 1. 0 mol • L_1 • s-1 D. v(B2)= 1. 2 mol • L_1 • s_1
3. 下列电离方程式书写正确的是
A. H2O 4-OH B. H2CO3 一2H+ +CO
C. NaHS()3 ==Na+ +H+ +S(上- D.Fe(OH)3=Fe+3OH
4. 一定温度下,满足下列条件的溶液一定呈酸性的是
A.能与金属A1反应放出H? B. PH = 6. 8
C-c(H,»c(OH-) D.滴加甲基橙溶液变黄
5. 控制变量法是科学研究的重要方法。向5 mb H2O2溶液中滴入2滴1 mol • irFeCh溶
液,下列条件下分解速率最快的是
选项
c(H2Q 溶液)/mol - L-1
反应温度/t
A
5
10
B
5
40
C
4
10
D
4
40
CHjCOOH
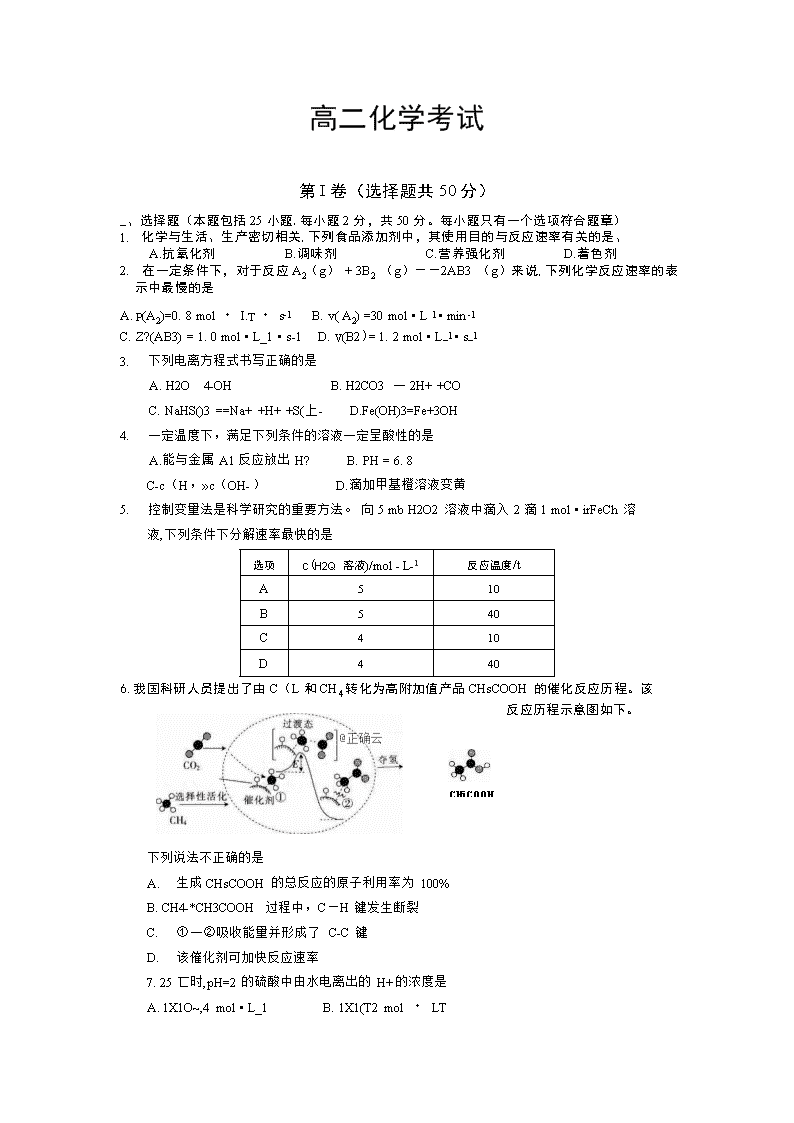
6.我国科研人员提出了由C(L和CH4转化为高附加值产品CHsCOOH的催化反应历程。该
反应历程示意图如下。
下列说法不正确的是
A. 生成CHsCOOH的总反应的原子利用率为100%
B. CH4-*CH3COOH过程中,C—H键发生断裂
C. ①一②吸收能量并形成了 C-C键
D. 该催化剂可加快反应速率
7. 25匸时,pH=2的硫酸中由水电离出的H+的浓度是
A. 1X1O~,4 mol • L_1 B. 1X1(T2 mol ・ LT
C. 1X10-7 mol ・ L_1 D. 1X1O~12 mol ・ L
8.下列措施能使氨水的电离平衡逆向移动的是
A.加入少量NHqCl固体 B.加入少量NaCl固体
C.通入少量HC1气体 D.加入少量水
9.在恒温恒容的密闭容器中发生可逆反应:2NO(g)+()2(g)=2NC)2(g)。其他条件相同时,
按下列各组投料进行反应,平衡时反应速率最快的是
A. 2 mol NO2 和 1 mcl O2
C. 1 mol NO 和 2 mol ()2
10.下列关于酸碱中和滴定的说法中正确的是
A. 一般用石蕊试液作中和滴定的指示剂
C.标准液浓度越大,滴定误差越小
B. 1 mol NO 和 1 mol O2
D. 2 mol NO 和 1 mol O2
B.滴定时应控制滴加速率:先快后慢
D.滴定时,眼睛注视滴定管内液面的变化
11.对于某可逆反应平衡体系,下列措施一定会使平衡移动的是
A.升高温度 B.使用催化剂
C.改变体系压强 D.改变各组分浓度
12. 在体积可变的密闭容器中发生可逆反应:2N()2(g)=2N()(g)+()2(g)。能作为反应达到
平衡状态的标志是
A. 单位时间内生成71 mol O2的同时生成n mol N()2
B. NQ、N()、O2三者的物质的量浓度之比为2 : 2 : 1
C. 混合气体的密度不再改变
D. 容器中气体压强不再变化
13. 工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是
A. 增大压强,①一②之间的能量差值会增大
B. 合成氨的正逆反应的熠变相同
C. 合成氨的过程是吸热反应
D.若使用催化剂,生成等量的NH3需要的时间更短
14. 下列说法中正确的是
A. AH>0,AS>0的反应一定可以自发进行
B. 氯酸钾分解是一个爛增的过程
C. 电解水产生氢气、氧气的反应具有自发性
D. 可逆反应正向进行时,正反应具有门发性,—定小于零
15. 下列措施或事实不能用勒夏特列原理解释的是
A. 新制的氯水在光照下颜色变浅
B. H2、l2、HI平衡混合气加压后颜色变深
C. 在合成氨的反应中,加压有利于氨的合成
D. Fe(SCN)3溶液中加入Na()H后溶液颜色变浅
16.体积、浓度均相同的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于产生的氢气体积(V)随时间(“变化的示意图正确的是
A B C D
17. 在有、无催化剂时,HI分解反应的能量随反应进程的变化关系如
图所示。下列说法正确的是
A. 其他条件不变时,升高温度,平衡体系中HI的含量降低
B. 图示中无催化剂的反应熔变更大
C. 其他条件不变时,增大压强,可提高HI的平衡转化率
D. 催化剂可提高分子的能量,加快反应速率
18.在一密闭容器中,反应aA(g)—〃B(g)+cC(g)达到平衡后,保持温度不变,将容器体积增大一倍,最终测得A的物质的量浓度为原来的40%。下列说法不正确的是
A. 平衡向正反应方向移动 B. aa
C. a点所示溶液中:c(A_) = 2c(Na")
D. c点时,lg弓洁I))= 2
第II卷(非选择题共50分)
二、非选择题(本题包括4小题,共50分) j
26. (13分)用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素。 ・
I.实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
反应原理:□ MnOr +1 I H2GO4 + ~~| ~^| | Mn2++| | CQ f +| ] H2O
(1) 配平上述离子方程式。
(2) 滴定时KMnCh溶液应盛装于 (填“酸式”或“碱式”)滴定管中,当达到滴定
终点时,现象为 。
U .探究影响化学反应速率的因素
实验编号
H2GO4溶液
酸性KMn()4溶液
温度(£)
浓度(mol • L 1)
体积(mL)
浓度(mol • L'1)
体积(mL)
①
0.10
2.0
0.010
4.0
25
②
0. 20
2.0
0.010
4.0
25
③
0. 20
2.0
0.010
4.0
50
3)实验①和实验②是探究 对化学反应速率的影响;实验②和实验③是
探究 对化学反应速率的影响。
(4) 若实验①测得溶液完全褪色的时间为40 s,忽略混合前后溶液体积的微小变化,则这段时间内平均反应速率v(KMnO4)= mol • L_1 • min-1 o
(5)已知50 *时c(Mn(X )〜t的变化曲线如图。若保持其他条件不变请在图中画出25 °C时,c(Mn(K )〜/的变化曲线示意图
27.(10分)葡萄酒中SO2有杀菌、增加酸度和帮助葡萄酒抗氧化等作用。中华人民共和国国家标准(GB276O-2O11)规定葡萄酒中SO2最大使用量为0. 25 g・。某兴趣小组用如图所示装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
1)仪器C的名称是 ,仪器A的作用是 。仪器B中加入300 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全
(2) 除去C中过量的H2O2,然后用0. 10 mol • 的Na()H标准溶液进行滴定(选酚酥作
指示剂),若滴定终点时溶液的pH=9,则滴定终点现象为
(3) 滴定至终点时,消耗Na()H溶液25. 00 mL,该葡萄酒中s6^量为-------- g •(保
留两位小数)。
(4)由于盐酸的挥发性,该测定结果往往比实际值 (填“偏高”或“偏低”),在不改变
装置的情况下,请提出一种简单的改进方法:_______________________
28 (13分)在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2 + 3H2= 2NH3 H<0o
⑴ 反应开始阶段,U(正) (填“〉”“V”或“=”曲逆),随后讥正)逐渐 (填“增大”或“减小”,下同),P(逆)逐渐 ,反应达到平衡时,讥正) (填“〉”“V”或“=")V(逆)。
2.达到平衡后,若正反应速率用"(N2)表示,逆反应速率用V(H2)表示75,则V(N2)=____z/ (H2)。
3.下列措施中能加快反应速率并提高氢气的转化率的是 (填字母)。
A. 其他条件不变时,压缩容器体积
B. 其他条件不变时,升高反应体系温度
C. 使用合适的催化剂
D. 保持容器体积不变,充入一定量的氮气
4.实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的
原因: 。
⑸写出G应氨反应N2+3H2 一2NH3的平衡常数表达式: ,升高温度时K值 (填“增大”“减小”或“不变”)。
29. (14分)在1. 0 L真空密闭容器中充入4. 0 mol A(g)和4. 0 mol B(g),在一定温度下进行反应:A(g)+B(g)—*C(g) 测得不同时刻该容器内物质的物质的量如下表
时间/min
0
10
20
30
40
??(A)/mol
4.0
2.5
1. 5
n2
兀3
“(C)/mol
0
1.5
3
3
5-
删
回答下列问题:
(1) 随着温度的升高,该反应的化学平衡常数减小,则 (填“>”“<”或“ = ”)0,反应从起始到20 min内C的平均反应速率是 。
(2) 该温度下,上述反应的化学平衡常数为 。平衡时体系内气体的总压强是反应起始时总压强的 倍。
3.下列选项中能说明该反应在一定温度和恒容下达到平衡状态的是 。
A. 反应速率:%(正)+如(正)=先(逆)
B. A的质量不再改变
C. B的转化率不再改变
D. 密度不再改变
4.若反应C(g)—A(g)+B(g)进行时需加入稀释剂X气体(不参与反应),则C的平衡转
化率与体系的温度、压强、X的物质的量的关系如图I、n所示。
②由图11可知,当其他条件不变时,增大X的物质的量,C的平衡转化率将 (填
“增大”“减小”或“不变”)。