- 848.00 KB
- 2021-04-29 发布
课题2 氯碱生产
1.了解电解的概念和电解食盐水的原理,并能写出相应的电极反应式和总反应的化学方程式。(重点)
2.知道电解槽的基本结构、作用及其主要类型,能说明离子膜电解槽的工作原理,知道离子膜法电解制烧碱的主要工艺流程,了解精制盐水的原理和方法。(重难点)
3.能举例说明氯碱工业产品的主要用途。
氯碱生产的核心技术——电解
1.电解
(1)定义:使电流通过电解质溶液或熔融态的电解质,在阴、阳两极分别发生还原反应和氧化反应的过程。
(2)电解装置——电解槽
电解槽
(3)电解原理
阴极:阳离子移向阴极,得电子,发生还原反应。
阳极:阴离子移向阳极,失电子,发生氧化反应。
2.电解饱和食盐水
(1)离子移动方向
Na+、H+移向阴极,Cl-、OH-移向阳极。
(2)电极反应及总反应
阴极:2H++2e-===H2↑,
阳极:2Cl--2e-===Cl2↑,
总反应:2NaCl+2H2O2NaOH+Cl2↑+H2↑。
(3)现象
向溶液中滴入酚酞时,阴极变红色;阳极出现黄绿色气体,能使润湿的KI-淀粉试纸变蓝色。
1.电解饱和食盐水时,如何检验阴极气体成分?
【提示】 收集一小试管阴极产生的气体,靠近酒精灯火焰,产生淡蓝色火焰,并发出“噗噗”响声,证明有H2生成。
氯碱生产的基本装置——电解槽
1.如何有效地隔开电解产物
电解槽的阴极室和阳极室用阳离子膜隔开,精制饱和食盐水进入阳极室,去离子水进入阴极室。阳离子膜具有选择透过性,它只允许阳离子Na+透过膜进入阴极室,而阴离子Cl-、OH-和气体则不能透过。
2.选择什么样的电极材料
阳极材料:以钛为基体、其表面涂有钌和钛氧化物涂层的金属。
阴极材料:低碳钢。
2.阳离子膜和阴离子膜的作用有什么不同?
【提示】 阳离子膜只允许阳离子透过,阴离子和分子不能透过;阴离子膜只允许阴离子透过,阳离子和分子不能透过。
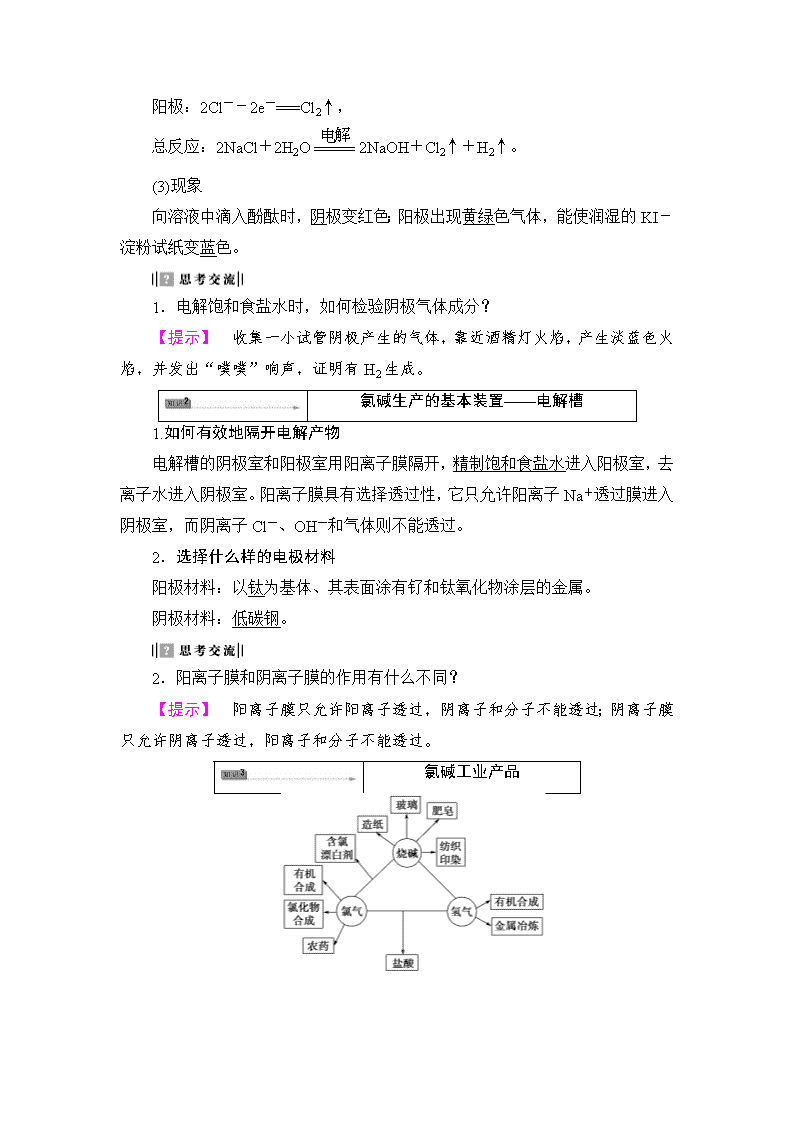
氯碱工业产品
电解产物的判断
【问题导思】
①电解时,阴离子一定在阳极放电吗?
【提示】 不一定。阳极材料为活性电极时,材料本身失电子而放电,溶液中阴离子不放电。
②电解饱和食盐水时,向溶液中滴入酚酞试液,为什么阴极区溶液变红色?
【提示】 阴极:2H++2e-===H2↑,使阴极区溶液碱性增强。
③你知道阳极、阴极上离子的放电顺序吗?
【提示】 见要点1、2。
1.阳极产物判断
首先看电极,如果是活性电极(金属活动性顺序中Ag以前的金属),则电极材料失电子,电极被溶解,溶液中的阴离子不能失电子。如果是惰性电极(Pt、Au、石墨),则要再看溶液中的离子的失电子能力。此时根据阴离子放电顺序加以判断。
阴离子放电顺序:
S2->I->Br->Cl->OH->含氧酸根。
2.阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>
K+。
下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
【解析】 电解食盐水时,2NaCl+2H2O2NaOH+H2↑+Cl2↑,H2在阴极产生,Cl2在阳极产生。由图可知每一装置左侧都是用来收集H2的,而右侧是用来检验Cl2(使淀粉KI溶液变蓝)。
【答案】 D
电解槽中电子流向和电流方向:电子流向:阳极→正极→负极→阴极(直流电源相当于“电子泵”)
电流方向
1.家用消毒液的发生器是以精盐和自来水为反应物,通电时,发生器电解槽的极板上产生大量气泡,切断电源后,生成液具有强烈的杀菌消毒能力。与该反应器工作原理直接有关的化学方程式是( )
A.2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
B.H2+Cl22HCl
C.2NaCl+2H2O2NaOH+H2↑+Cl2↑
D.2HClO===2HCl+O2↑
【解析】 根据发生器的反应物和反应条件,可以推测在发生器中电解食盐水,选项C符合题意。
【答案】 C
粗盐的精制
【问题导思】
①氯碱生产中,能否用粗盐水代替精制盐水?
【提示】 不能,粗盐水中的泥沙,以及电解时生成的Ca(OH)2、Mg(OH)2沉淀,损坏离子交换膜。
②除去粗盐中的SO、Ca2+、Mg2+、Fe3+分别用什么试剂?
【提示】 SO——BaCl2、Mg2+、Fe3+——NaOH、Ca2+——Na2CO3。
③粗盐提纯时,加入试剂的顺序中,Na2CO3能否排在BaCl2之前?为什么?
【提示】 不能。过量的Ba2+须用CO除去,故加入顺序中,Na2CO3一定排在BaCl2之后。
1.粗盐的成分
粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质,不符合电解要求,因此必须经过精制。
2.杂质的危害
Ca2+、Mg2+等金属离子在碱性环境中会生成沉淀,损坏离子交换膜;此外,杂质的存在会使得到的产品不纯。
3.除杂质的过程
(1)除杂质时所加试剂的顺序要求是:Na2CO3必须在BaCl2之后;加入盐酸在过滤之后。
(2)试剂加入顺序有多种选择:
①BaCl2、NaOH、Na2CO3、过滤、盐酸
②BaCl2、Na2CO3、NaOH、过滤、盐酸
③NaOH、BaCl2、Na2CO3、过滤、盐酸
为了除去粗盐中Ca2+、Mg2+、Cu2+、Fe3+、SO及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量盐酸
④加过量Na2CO3溶液 ⑤加入过量的BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②④⑤①③ D.⑤②④①③
【解析】 按除杂的基本要求,为了保证杂质离子完全除去,所用试剂一般应稍过量,但又不能引入新杂质,而且方法要尽可能简单。解题时,要弄清每加一种试剂的作用以及过量的试剂如何在下一步除去。过量的NaOH溶液是为了使粗盐水中的Mg2+、Cu2+、Fe3+等离子形成沉淀,多加的NaOH溶液最后可用HCl溶液中和;加BaCl2可除去SO;加过量的Na2CO3溶液是为了使粗盐水中的Ca2+以及上一步中过量的Ba2+形成沉淀而除去。从以上分析可以知道Na2CO3溶液必须在加入BaCl2溶液之后才能加入,以保证过量的Ba2+不致引入新杂质;而盐酸应该在过滤操作后加入,以防止在加入酸调节溶液pH时,某些沉淀会溶解或部分溶解。至于NaOH溶液和BaCl2溶液加入的先后顺序,则没有原则性的差别。根据上述分析可知D选项符合题意。
【答案】 D
除杂原则:(1)除杂试剂需过量;(2)过量试剂需除尽;(3)除去多种杂质要考虑加入试剂的顺序;(4)选择最佳的除杂途径。
2.氯碱厂电解饱和食盐水制取NaOH的工艺流程如图所示。
【导学号:28920021】
依据图,完成下列填空。
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________________;与电源负极相连的电极附近,溶液pH______________(填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
_______________________________________________________________;
_______________________________________________________________。
(3)如果精盐中SO含量较高,必须添加钡试剂除去SO,该钡试剂可以是__________。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______________、冷却、______________(填操作名称)除去NaCl。
(5)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;在用离子交换膜法电解食盐水时,阳离子交换膜将电解槽分隔为阳极室和阴极室的目的是____________________________________________________
_______________________________________________________________。
采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2O,相应的化学方程式为_____________________________________________
_______________________________________________________________。
【解析】 与电源正极相连的极是电解池阳极,阴离子在电极上放电。而阴极上H+放电后导致OH-富集,碱性增强。除杂时以不引入难除去离子为宗旨,尽量避免加入杂质离子,故除Ca2+用Na2CO3,除Mg2+用NaOH,钡盐可选用Ba(OH)2、BaCl2
。利用溶解度的差异可以用蒸发结晶法除去NaOH中NaCl。而不采用隔膜时Cl2与NaOH直接接触生成NaClO。
【答案】 (1)2Cl--2e-===Cl2↑ 升高
(2)Ca2++CO===CaCO3↓ Mg2++2OH-===Mg(OH)2↓ (3)ac (4)蒸发 过滤
(5)防止阴极产生的H2和阳极产生的Cl2混合而引起爆炸并避免Cl2和NaOH溶液反应生成NaClO而影响烧碱的质量
2NaCl+2H2O2NaOH+H2↑+Cl2↑、
Cl2+2NaOH===NaCl+NaClO+H2O
1.食盐水中的4种离子:Na+、Cl-、H+、OH-。
2.电解饱和食盐水的3个反应式:
阳极:2Cl--2e-===Cl2↑
阴极:2H++2e-===H2↑
总反应:2NaCl+2H2O2NaOH+Cl2↑+H2↑
3.阳离子膜的特点:允许阳离子通过,不允许阴离子、分子通过。
4.氯碱工业的3种主要产品:烧碱、氯气、氢气。
1.下列物质不属于氯碱工业产品的是( )
A.液氯 B.盐酸
C.乙烯 D.漂白粉
【解析】 由2NaCl+2H2O2NaOH+Cl2↑+H2↑可知,液氯是氯碱工业产品,则含氯物质(盐酸、漂白粉)也属于氯碱工业产品。
【答案】 C
2.精制食盐水时,下列物质中不必用到的有( )
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液
⑦Ba(NO3)2溶液
A.③④⑤ B.③⑤⑦
C.②⑤⑥ D.②④⑤⑦
【解析】 精制食盐水时,不必用到的试剂是K2CO3溶液、硫酸和Ba(NO3)2溶液,若选用这些试剂时,将会分别引入钾盐、硫酸盐和硝酸盐等杂质。
【答案】 B
3.“粗盐提纯”实验中,蒸发时,正确的操作是( )
A.把浑浊的液体倒入蒸发皿内加热
B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热
D.蒸发皿中出现较多量固体时即停止加热
【解析】 “粗盐的提纯”实验涉及溶解、过滤、蒸发结晶等基本操作内容,三项操作从始至终均要使用玻璃棒(加速溶解、引流、防迸溅)。为达到提纯目的,过滤后要对澄清滤液进行蒸发,加热至蒸发皿中出现较多固体时,停止加热,利用蒸发皿的余热使滤液蒸干(最后用玻璃棒把固体转移到纸上,称量后回收)。
【答案】 D
4.下列关于用离子膜电解槽电解饱和食盐水的叙述不正确的是
( ) 【导学号:28920022】
A.精制饱和食盐水注入阳极室
B.Cl-和OH-透过阳离子膜进入阳极室
C.阴极区溶液使酚酞试液显红色
D.阳极产生使湿润的淀粉碘化钾试纸变蓝的气体
【答案】 B
5.氢氧化钠是一种用途十分广泛的重要化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是
_______________________________________________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是_____________________________________________________________
_______________________________________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是__________。(填字母)
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
【解析】 电解时H+、Cl-分别在阴、阳两极上得失电子,产生H2和Cl2,阳极材料必须选择不易被Cl2腐蚀的材料;增大面积、提高温度、增大电压都有利于加快电解食盐水的速率。
【答案】 (1)阴极产生的Cl2不易腐蚀钛 既能防止H2、Cl2混合爆炸,又能避免Cl2与NaOH反应
(2)abd
学业分层测评(五)
(建议用时:45分钟)
[学业达标]
1.关于电解NaCl的水溶液,下列叙述正确的是( )
A.电解时阳极得到Cl2,阴极得到钠
B.在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
【解析】 电解时阴极:2H++2e-===H2↑(H+由H2O提供后剩余OH-显碱性),阳极:2Cl--2e-===Cl2↑(Cl2有一部分溶于水,呈强氧化性,滴入KI后生成I2)。
【答案】 B
2.下列关于离子交换膜电解槽的叙述,错误的是( )
A.精制的饱和食盐水进入阳极室
B.纯水(加少量NaOH)进入阴极室
C.阴极产物为NaOH和氢气
D.电解槽的阳极用金属铁网制成
【解析】 离子交换膜电解槽阳极产物为Cl2,阴极为NaOH和H2。阳极发生氧化反应:2Cl--2e-===Cl2↑,若是铁做阳极,则Fe原子失去电子,阳极不会得到Cl2;阴极发生还原反应:2H++2e-===H2↑,需补充H2O,Na+自阳极室进入阴极室后,与OH-形成NaOH。
【答案】 D
3.目前下列工艺过程没有直接使用离子交换技术的是( )
A.硬水的软化
B.电解饱和食盐水制造NaOH
C.电渗析淡化海水
D.海水中提取金属Mg
【解析】 海水中提取金属Mg的基本过程为:海水氢氧化镁氯化镁溶液氯化镁晶体无水氯化镁金属镁。
【答案】 D
4.下列说法错误的是( )
A.电解饱和食盐水的工厂可以生产盐酸
B.电解饱和食盐水在阴极区有NaOH生成
C.用离子交换膜法制烧碱不会对环境造成污染
D.氯碱工业产品可用于造纸、金属冶炼等行业
【解析】 氯碱工业会产生三废(废气、废水、废渣),故必对环境造成污染。
【答案】 C
5.氯碱工业的电解槽使用的交换膜是( )
A.阴离子交换膜 B.阳离子交换膜
C.滤纸 D.塑料薄膜
【解析】 氯碱工业的电解槽中,使用阳离子交换膜,防止Cl2和H2混合。
【答案】 B
6.在氯碱工业中,原料盐中的杂质离子危害很高,能破坏离子膜,以下对Ca2+、Mg2+、Fe3+、SO除去顺序不合理的是( ) 【导学号:28920023】
A.BaCl2、NaOH、Na2CO3
B.BaCl2、Na2CO3、NaOH
C.NaOH、BaCl2、Na2CO3
D.Na2CO3、BaCl2、NaOH
【解析】 除杂原则是每一种试剂必须过量,不能引入杂质离子,或者引入的杂质离子利用后加试剂能除去。而D选项加入BaCl2后,再加NaOH时不能将过多的钡离子除去,从而引入新的杂质。
【答案】 D
7.用惰性电极电解未精制的食盐水,食盐水装在U形管内。结果很快在某一电极附近出现食盐水浑浊现象。造成浑浊的难溶物主要是( )
A.碳酸镁 B.硫酸钡
C.氢氧化镁 D.碳酸钡
【解析】 未精制的食盐水中含Ca2+、Mg2+,电解时产生的NaOH与Mg2+反应生成Mg(OH)2沉淀。
【答案】 C
8.取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯做电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
A.b电极是阴极
B.a电极与电源的正极相连
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
【解析】 a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色,说明a极产生了Cl2,所以a极与电源的正极相连,即a为阳极,电极反应式为2Cl--2e-===Cl2↑,b为阴极,2H++2e-===H2↑,电解促进水的电离,所以b极附近的pH增大。
【答案】 D
9.NaCl是一种化工原料,可以制备一系列物质(见下图)。下列说法正确的是( )
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
【解析】 A项Na2CO3比NaHCO3的溶解度大;C项不是二者不反应,而是类似钝化作用,反应产物的覆盖和隔离作用阻碍了反应的进一步进行;D项制取Na2CO3、NaHCO3的过程不涉及氧化还原反应。
【答案】 B
10.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2
被完全吸收,制得有较强杀菌能力的消毒液,设计了如图所示的装置,则对电源电极名称和消毒液的主要成分判断正确的是( )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极:NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
【解析】 电解饱和食盐水生成Cl2、H2和NaOH,同时在电解池内制得消毒液,则该消毒液的有效成分是Cl2和NaOH反应生成的NaClO。在图示的电解池中,要使Cl2和NaOH充分反应,应使Cl2生成于下方、NaOH生成于上方。在饱和食盐水的电解池中,Cl2生成于阳极、NaOH生成于阴极。 电解池的阳极连接电源的正极,阴极连接电源的负极。则a是负极,b是正极。
【答案】 B
11.某兴趣小组设计如下图所示微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表A指针偏转。下列有关描述正确的是( )
A.断开K2,闭合K1时,总反应的离子方程式为:
2H++2Cl-Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应式为:
Cl2+2e-===2Cl-
D.断开K1,闭合K2时,石墨电极做正极
【解析】 断开K2,闭合K1时,构成电解池,反应的离子方程式为2H2O+2Cl-H2↑+Cl2↑+2OH-,石墨电极为阳极,发生反应:2Cl--2e-===Cl2↑;铜电极为阴极,发生反应:2H++2e-===H2↑
,所以铜电极附近溶液变红。断开K1,闭合K2时,构成原电池,其中石墨电极为正极。
【答案】 D
[能力提升]
12.为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐滤液精盐
(1)判断BaCl2已过量的方法是_______________________________________
_________________________________________________________________
________________________________________________________________。
(2)第④步中,相关的离子方程式是__________________________________
_________________________________________________________________
________________________________________________________________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是___________
_________________________________________________________________
________________________________________________________________。
(4)为检测精盐纯度,需配制250 mL 0.2 mol·L-1 NaCl(精盐)溶液,如右图是该同学转移溶液的示意图,图中的错误是_________________________________________________________
________________________________________________________。
【解析】 加入BaCl2、NaOH、Na2CO3等沉淀剂后,产生BaSO4、Mg(OH)2、BaCO3、CaCO3沉淀,还有过量Na2CO3和NaOH,需加入盐酸使它们转变成NaCl。但如果先加盐酸再过滤,Mg(OH)2、BaCO3、CaCO3都可能溶解,造成产品纯度不高。
【答案】 (1)取第②步后的上层清液1~2滴于点滴板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊则表明BaCl2已过量
(2)Ca2++CO===CaCO3↓;
Ba2++CO===BaCO3↓
(3)先加盐酸会有少量CaCO3、BaCO3等溶解,从而影响制得精盐的纯度
(4)未用玻璃棒引流;未采用250 mL容量瓶
13.电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;
X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为_________________________________,
在X极附近观察到的现象是_______________________________________。
②Y电极上的电极反应式为_______________________________________,
检验该电极反应产物的方法是______________________________________。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是________________,电极反应式为___________________。
②Y电极的材料是________________,电极反应式为___________________。
(说明:杂质发生的电极反应不必写出)
【解析】 (1)用惰性电极电解饱和食盐水时,阳极反应:2Cl--2e-===Cl2↑;阴极反应:2H++2e-===H2↑。与电源正极相连的为阳极,反之为阴极。所以X为阴极,Y为阳极。X极在反应过程中消耗了H2O电离出的H+,溶液呈碱性,加入酚酞试液变成红色;Y极产生Cl2,能使湿润的淀粉KI试纸变成蓝色。
(2)电解精炼Cu时,用含杂质的Cu为阳极,纯Cu为阴极。反应过程中阳极上的Cu以及比Cu活泼的金属失去电子,成为离子,进入溶液,活泼性比Cu差的金属形成阳极泥;在阴极只有Cu2+能得电子成为单质,其他较活泼金属对应的离子不能得电子。根据装置图,X为阴极,Y为阳极。所以,X电极的材料是纯铜,电极反应式为Cu2++2e-===Cu;Y电极的材料是粗铜,电极反应式为Cu-2e-===Cu2+。
【答案】 (1)①2H++2e-===H2↑ 放出气体,溶液变红 ②2Cl--2e-===Cl2↑ 把湿润的淀粉碘化钾试纸放在Y电极附近,试纸变蓝色 (2)①纯铜 Cu2++2e-===Cu ②粗铜 Cu-2e-===Cu2+
14.海水是取之不尽的化工原料资源库,从海水中可提取各种化工原料。下列是工业上对海水的几项综合利用的示意图: 【导学号:28920024】
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是_____________________。
(2)电解饱和食盐水时,与电源正极相连的电极上发生的反应为______________。与电源负极相连的电极附近溶液pH________(填“变大”、“不变”或“变小”)。若1 mol 电子的电量为96 500 C,则用电流强度为100 A的稳恒电流持续电解3分13秒,则在两极上共可收集到气体______mL(STP)。若保证电解后饱和食盐水的浓度不变,则可采取的方法是___________________。
(3)由MgCl2·6H2O晶体脱水制无水MgCl2时,MgCl2·6H2O晶体在________气氛中加热脱水,该气体的作用是________________________________________
_________________________________________________________________
________________________________________________________________。
(4)电解无水MgCl2所得的镁蒸气可以在下列________气体中冷却。
A.H2 B.N2
C.CO2 D.O2
【解析】 (1)该小题属离子除杂题。除杂原则是在除去Ca2+、Mg2+、SO时,不能带入杂质离子。所以,解此题的关键是把握好加入离子的顺序:①Ba2+必须在CO之前加入;②CO、OH-必须在H+之前加入,所以B、C不分先后,而D、A本身既分前后,又必须放在B、C之后才能满足条件。
(2)电解饱和食盐水时,与正极相连的阳极发生的反应是:2Cl--2e-===Cl2↑,与负极相连的阴极发生的反应是:2H++2e-===H2↑。H+不断消耗,使得溶液中c(OH-)增大,pH变大。电解中外逸的是Cl2、H2,所以要确保原溶液浓度不变,只能向体系中通入一定量的HCl气体以补足损失的氢、氯。易错处是加入盐酸,使溶液浓度变小。
(3)抑制水解平衡MgCl2+H2OMg(OH)Cl+HCl正向移动。
(4)镁蒸气可以与氮气、氧气和二氧化碳反应,所以只能用氢气来冷却。
【答案】 (1)BCDA(或CBDA)
(2)2Cl--2e-===Cl2↑ 变大 4 480 向电解液中通入一定量的HCl气体
(3)HCl 抑制Mg2+水解
(4)A
相关文档
- 2020版高考一轮复习化学通用版学案2021-04-28 17:51:426页
- 2020版高考一轮复习化学通用版学案2021-04-28 17:50:3913页
- 2020版高考一轮复习化学通用版学案2021-04-28 14:31:598页
- 2020版高考化学一轮复习化学能与热2021-04-28 12:51:4213页
- 2020届高考化学一轮复习化学反应速2021-04-28 11:03:2028页
- 步步高高考化学一轮复习化学物质及2021-04-28 01:59:2615页
- 2020届高考化学一轮复习化学平衡状2021-04-28 00:36:558页
- 2021届高考化学一轮复习化学反应速2021-04-27 23:28:5138页
- 2020届高考化学一轮复习化学平衡常2021-04-27 20:57:077页
- 2021届高考化学一轮复习化学实验方2021-04-27 20:54:357页