- 113.50 KB
- 2021-04-28 发布
2017-2018学年河北省定州中学高二上学期第一次月考化学试卷
一、选择题
1.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 2mol C B. 2mol A、3mol B和1mol He(He不参加反应)
C. 1mol B和1mol C D. 2mol A、3mol B和3mol C
2.下列表述正确的是( )
A. 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═ 2H2O(g) △H =﹣571.6 kJ/mol
B. 焓减小的反应通常是自发的,因此不需要任何条件即可发生
C. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D. 等质量的硫磺固体和硫蒸气分别完全燃烧,后者放出的热量多
3.几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,正确的是( )
元素符号
X
Y
Z
L
M
Q
原子半径/nm
0.160
0.143
0.102
0.099
0.077
0.066
主要化合价
+2
+3
+6、-2
+7、﹣1
+4、﹣4
-2
A. 离子半径大小:r(X2+)>r(Q2-)
B. Y与Q形成的化合物不能跟氢氧化钠溶液反应
C. 最高价氧化物的水化物的酸性:L>Z
D. Z的单质可在氧气中燃烧生成ZO3
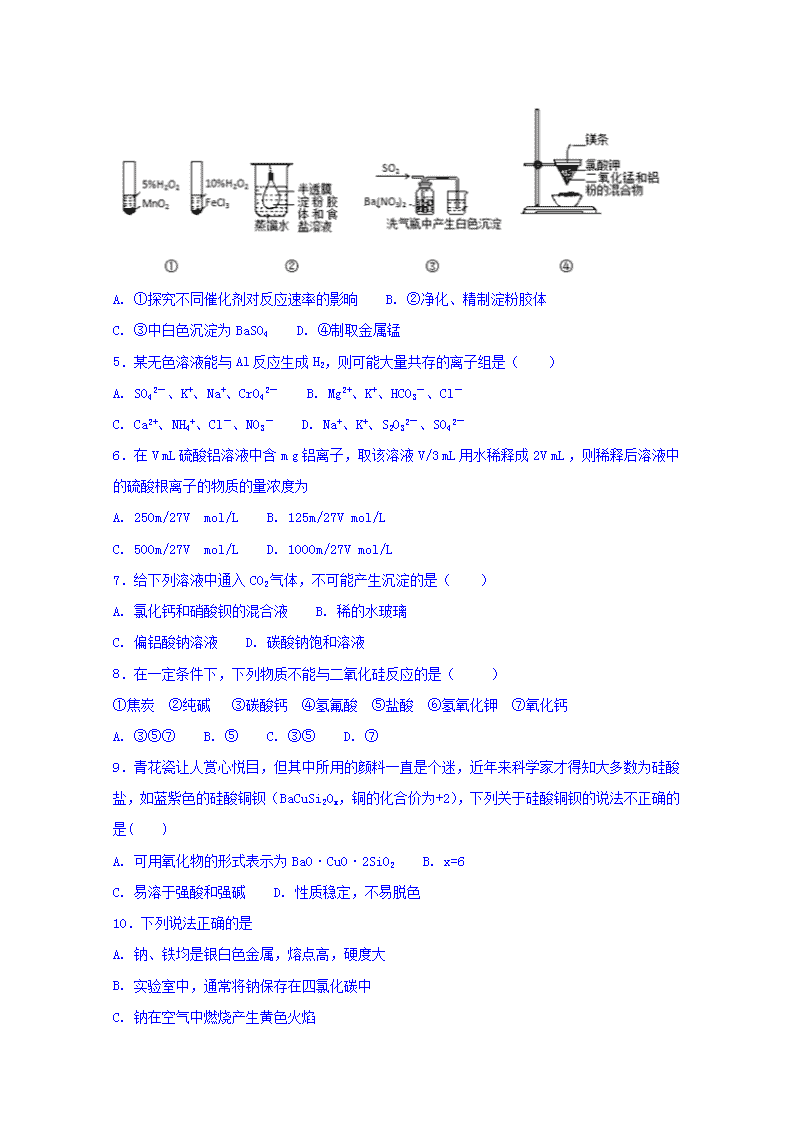
4.下列实验操作或结论不正确的是( )
A. ①探究不同催化剂对反应速率的影晌 B. ②净化、精制淀粉胶体
C. ③中白色沉淀为BaSO4 D. ④制取金属锰
5.某无色溶液能与Al反应生成H2,则可能大量共存的离子组是( )
A. SO42-、K+、Na+、CrO42- B. Mg2+、K+、HCO3-、Cl-
C. Ca2+、NH4+、Cl-、NO3- D. Na+、K+、S2O32-、SO42-
6.在V mL 硫酸铝溶液中含m g铝离子,取该溶液V/3 mL 用水稀释成2V mL ,则稀释后溶液中的硫酸根离子的物质的量浓度为
A. 250m/27V mol/L B. 125m/27V mol/L
C. 500m/27V mol/L D. 1000m/27V mol/L
7.给下列溶液中通入CO2气体,不可能产生沉淀的是( )
A. 氯化钙和硝酸钡的混合液 B. 稀的水玻璃
C. 偏铝酸钠溶液 D. 碳酸钠饱和溶液
8.在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤盐酸 ⑥氢氧化钾 ⑦氧化钙
A. ③⑤⑦ B. ⑤ C. ③⑤ D. ⑦
9.青花瓷让人赏心悦目,但其中所用的颜料一直是个迷,近年来科学家才得知大多数为硅酸盐,如蓝紫色的硅酸铜钡(BaCuSi2Ox,铜的化合价为+2),下列关于硅酸铜钡的说法不正确的是( )
A. 可用氧化物的形式表示为BaO·CuO·2SiO2 B. x=6
C. 易溶于强酸和强碱 D. 性质稳定,不易脱色
10.下列说法正确的是
A. 钠、铁均是银白色金属,熔点高,硬度大
B. 实验室中,通常将钠保存在四氯化碳中
C. 钠在空气中燃烧产生黄色火焰
D. 高温时,铁与水蒸气反应生成氧化铁与氢气
11.下列物质中的杂质(括号中)可用加热的方法除去的是
A. Na2O2(Na2O) B. Na2O(Na2O2)
C. CO2(CO) D. KNO3(NaCl)
12.在NO2被水吸收的反应中,发生还原反应和氧化反应的物质的质量比为
A. 3∶1 B. 1∶3 C. 1∶2 D. 2∶1
13.某种氮的氧化物中氮与氧的质量比为7:16,则这种氮的氧化物的化学式是
A. NO B. NO2 C. N2O D. N2O5
14. 25%氨水和5%的氨水等体积混合,所得氨水的质量分数( )
A. 无法确定 B. =15% C. >15% D. <15%
15.“10%的氨水”的正确解释是( )
A. 100g氨水中含10gNH3•H2O B. 100g氨水中含10gNH3
C. 10gNH3溶于水形成100g溶液 D. 10gNH3溶于100gH2O形成的溶液
16.下列说法中不正确的是 ( )
⑴所有的化学反应都伴随着能量变化。⑵化学反应中的能量变化都是热能的变化。⑶不同的化学反应放出或吸收的热量一般是不相同的。⑷同一化学反应中反应物的用量不同时,放出或吸收的热量不会相同。⑸选择好的催化剂可以使由水制取氢气的同时放出热量。⑹因为氢气燃烧是放热的,所以水的分解反应一定是吸热的。( )
A. ⑴⑶ B. ⑷⑹ C. ⑵⑸ D. ⑴⑶⑷⑹
17.已知:① 2H2 (g) + O2 (g) = 2H2O (g) 2molH2燃烧放热Q1 kJ;②2 H2 (g) + O2 (g) = 2 H2O (l) 2molH2燃烧放热Q2 kJ;③H2 (g)+1/2 O2 (g) = H2O(g) 1molH2燃烧放热 Q3 kJ;其中Q1、Q2、Q3的大小关系为 ( )
A. Q1 = Q2 = Q3 B. 2Q3 = Q1 < Q2 C. Q3 < Q2 < Q1 D. Q1 < Q2 < 3Q3
18.已知:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:
容器
编号
起始时各物质的物质的量/mol
达平衡过程体系的能量变化
CO
H2O
CO2
H2O
①
1
4
0
0
放出热量:32.8 kJ
②
0
0
1
4
热量变化:Q
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等
19.化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A
食品工业用小苏打作焙制糕点的膨松剂
NaHCO3能与碱反应
B
人们大量使用铝制品
常温下铝不能与氧气反应
C
SiO2制成的玻璃纤维用于制造通讯光缆
SiO2导电能力强
D
液氨作制冷剂
氨易液化,液氨在汽化时会吸收大量的热量
A. A B. B C. C D. D
20.某同学在实验室进行了如图所示的实验,下列说法中错误的是( )
A. 利用过滤的方法,可将Z中固体与液体分离
B. X、Z烧杯中分散质相同
C. Y中反应的离子方程式为3CaCO3+2Fe3++3H2O===2Fe(OH)3(胶体)+3CO2↑+3Ca2+
D. Z中分散系能产生丁达尔效应
二、实验题
21.实验室可用如图所示的装置进行CO和CO2混合气体的分离和干燥。已知a为止水夹,b为分液漏斗丙的活塞,可供选用的试剂有NaHCO3溶液、NaOH溶液、浓硫酸、无水氯化钙、稀硫酸。试填空回答:
(1)广口瓶甲中应放的试剂为____________,广口瓶乙中应放的试剂为________________,
分液漏斗丙中应放的试剂为_______________。
(2)第一步应先分离出_______,分离时应先关闭________,打开_______,发生反应的化学方程式为___________。
(3)第二步再分离出_______时,应先关闭_________,打开_________,发生反应的化学方程式为_______________。
三、推断题
22.图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁,E是不溶于水的酸性氧化物,能与氢氟酸反应。
回答下列问题:
(1)组成单质Z的元素在周期表中的位置是________;M中存在的化学键类型为________;R的化学式是______________。
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为____________。
(3)已知A与1 mol Al反应转化为X时(所有物质均为固体),放出a kJ热量。写出该反应的热化学方程式:_____________________________________________________________。
(4)写出A和D的稀溶液反应生成G的离子方程式:__________________________________。
参考答案
ADCAD AABCC ACBDC CBDDB
21.(1)NaOH溶液;浓硫酸;稀硫酸
(2)CO;b;a;CO2+2NaOH=Na2CO3+H2O
(3)CO2;a;b;Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
22. 第三周期第IVA族 离子键、共价键 H2SiO3(或H4SiO4) 8Al(s)+3Fe3O4(s)=9Fe(s)+4Al2O3(s) △H=-8akJ·mol-1 3Fe3O4+28H++NO3-===9Fe3++NO↑+14H2O