- 437.00 KB
- 2021-04-16 发布
江苏省海门中学第一学期高一期中考试
(化学试卷)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,满分100分,考试时间90分钟。
请将选择题答案填涂在答题卡上
第Ⅰ卷(选择题 共50分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32
Cl-35.5 K—39 Cu-64 Ba—137
一、单项选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
1.当光束通过下列分散系:①有尘埃的空气 ②稀硫酸 ③蒸馏水 ④墨水,能观察到
丁达尔效应的是
A.①④ B.②③ C.①② D.②④
2.如果你家里的食用花生油混有了水,你将采用下列何种最佳方法分离它们
A.过滤 B.蒸馏 C.分液 D.萃取
3.想一想:Ba(OH)2(固态)、CuSO4(固态)、CH3COOH(液态)这些物质为什么归为一类,下列哪个物质还可以和它们归为一类
A.75%的酒精溶液 B.硝酸钠 C.Fe(OH)3胶体 D.豆浆
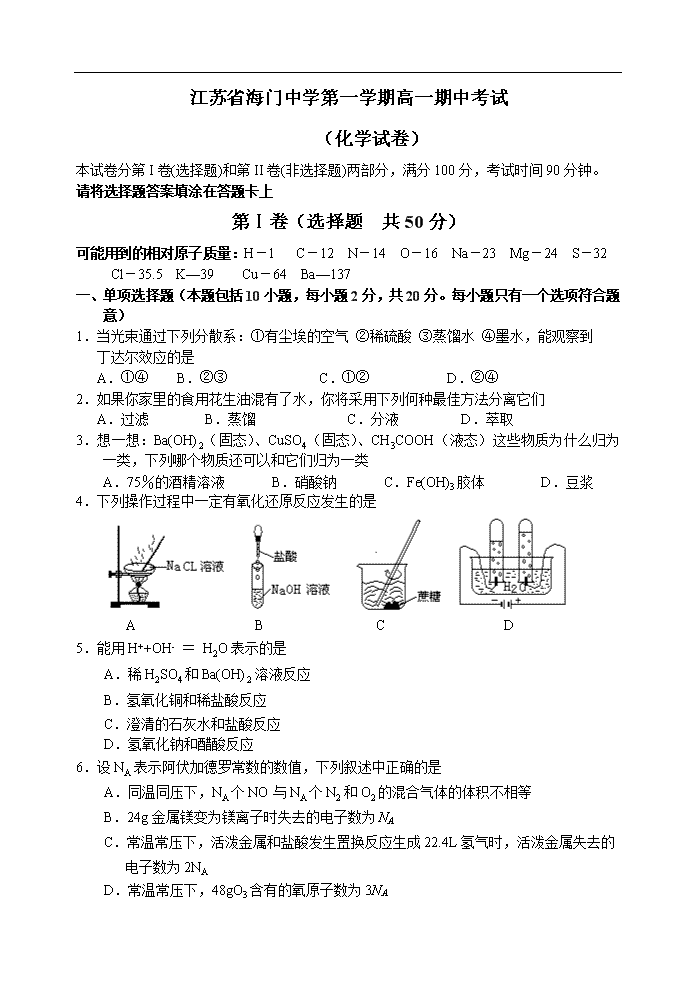
4.下列操作过程中一定有氧化还原反应发生的是
A B C D
5.能用H++OH- = H2O表示的是
A.稀H2SO4和Ba(OH)2溶液反应
B.氢氧化铜和稀盐酸反应
C.澄清的石灰水和盐酸反应
D.氢氧化钠和醋酸反应
6.设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
B.24g金属镁变为镁离子时失去的电子数为NA
C.常温常压下,活泼金属和盐酸发生置换反应生成22.4L氢气时,活泼金属失去的
电子数为2NA
D.常温常压下,48gO3含有的氧原子数为3NA
7.从平时学生实验中我们发现,同学们在进行实验时,出现许多不正确的操作方式,希
望同学们在今后的实验中,应该克服不规范的操作。请找出下列图示中正确的实验操作
A.除去CO的CO2 B.萃取时振荡混合液 C.稀释浓硫酸 D.向试管中滴加液体
8.对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
9.O2、SO2、SO3三者的质量比为2 : 4 : 5时,它们的物质的量之比
A. 2 : 4 : 5 B.1 : 2 : 3 C.1 : 1 : 1 D.2 : 2 : 3
10.将 a g 含NaOH样品溶解在 b mL 0.l mol·L-1 的硫酸中,再加入 c mL 0.1 mol·L-1 的
氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中 NaOH 的纯度是
A. [(b-c)/125a]×100% B. [(b-2c)/125a]×100%
C.[(b-c)/250a]×100% D.[(8b-8c)/a]×100%
二、选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个选项符合或
最符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两
个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小
题就为0分))
11.能电离出的Cl –数目与2mol NaCl溶液电离出的Cl –数目相同的是
A.1mol AlCl3 B.2mol KClO3 C.1mol MgCl2 D.1.5mol CaCl2
12.下列离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C.澄清石灰水与碳酸钠溶液混合:Ca2++CO32-=CaCO3↓
D.铁和盐酸反应:Fe+2H+=Fe2++H2↑
13.在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高B
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.称量时误用“左码右物”
14.下列除杂方案中,括号内为除去杂质所需的药品,其中正确的是
A.NaOH溶液中混有Ba(OH)2 (CuSO4)
B.Cu(NO3)2溶液中混有AgNO3(Cu粉)
C.CO2中混有CO (炽热的炭)
D.CO2中混有HCl气体(NaOH溶液)
15.下列关于0.1mol/LBa(NO3)2溶液中正确说法是
A.该溶液可由1L水中溶解0.1molBa(NO3)2制得
B.1L该溶液中含有Ba2+和NO3—总数为3×6.02×1022个
C.0.5L该溶液中Ba2+离子的物质的量浓度为0.2mol/L
D.0.5L该溶液中NO3—离子的物质的量浓度为0.1mol/L
16.菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷,西红柿中含有
比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是
A.因为河虾中含有砷元素,所以不能食用
B.“两者同食”发生的反应中维生素C作氧化剂
C.五价砷在维生素C作用下发生了还原反应
D.可以推测砒霜中所含的砷元素化合价为+5
17.科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法不正确的是
A.Wg该原子的物质的量是 B.该原子的摩尔质量是aNA
C.Wg该原子中含有个该原子 D.由已知信息可得:
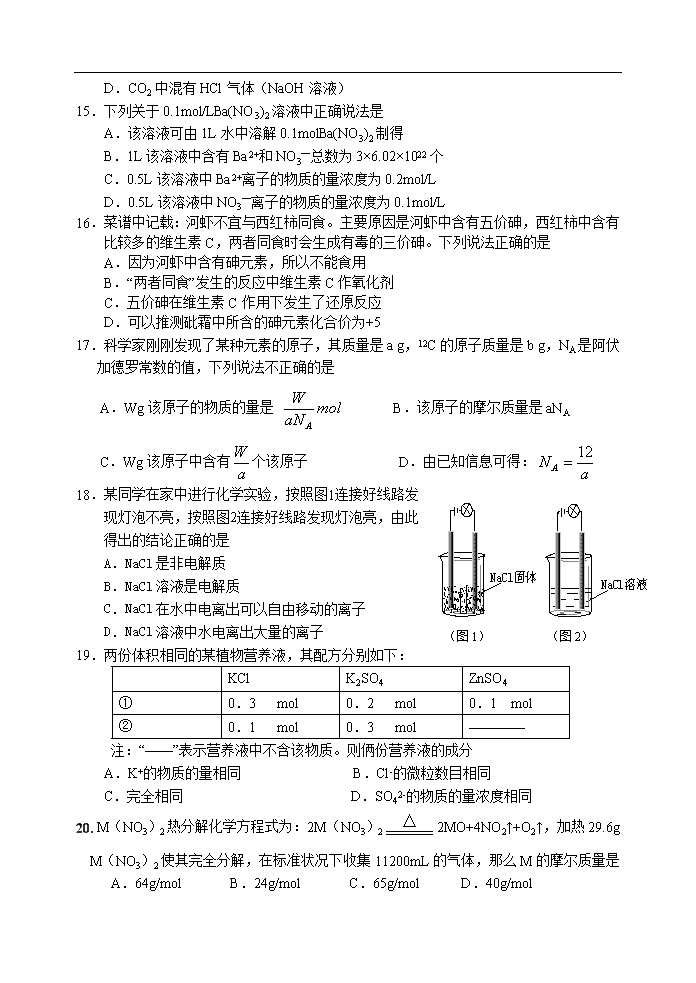
(图1)
(图2)
18.某同学在家中进行化学实验,按照图1连接好线路发
现灯泡不亮,按照图2连接好线路发现灯泡亮,由此
得出的结论正确的是
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水中电离出可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
19.两份体积相同的某植物营养液,其配方分别如下:
KCl
K2SO4
ZnSO4
①
0.3 mol
0.2 mol
0.1 mol
②
0.1 mol
0.3 mol
————
注:“——”表示营养液中不含该物质。则俩份营养液的成分
A.K+的物质的量相同 B.Cl-的微粒数目相同
C.完全相同 D.SO42-的物质的量浓度相同
20. M(NO3)2热分解化学方程式为:2M(NO3)22MO+4NO2↑+O2↑,加热29.6g M(NO3)2使其完全分解,在标准状况下收集11200mL的气体,那么M的摩尔质量是
A.64g/mol B.24g/mol C.65g/mol D.40g/mol
第Ⅱ卷(非选择题 共50分)
(注意:请把二卷答案填写在答题纸上)
三、(本题包括2小题,共17分)
21. (共9分)某样品中含有碳酸钠及少量的硫酸钠和氯化钠。某学生为了检验其成分,按照下图所示步骤进行实验。请将所加试剂及有关结论写在相应的空格中。(填写化学式)
22.(共8分)在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分
质量(g)
摩尔质量(g ·mol-1)
蔗糖
50.00
342
硫酸钾
0.50
174
阿司匹林
0.35
180
高锰酸钾
0.50
158
硝酸银
0.04
170
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A、蔗糖 B、硫酸钾 C、高锰酸钾 D、硝酸银
(2)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为______________ mol/L。(只要求写表达式,不需要计算)
(3)配制上述1 L“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、________________、
______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A、定容时俯视容量瓶刻度线
B、容量瓶在使用前未干燥,里面有少量蒸馏水
C、容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D、定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
四、(本题包括2小题,共17分)
23.(9分)有一瓶溶液只含Cl-、CO32-、SO42-、Na+、NH4+、K+、Mg2+ 七种离子中的某
几种。经实验:
① 原溶液白色沉淀;
② 将①所得溶液放出使湿润的红色石蕊试纸变蓝的气体;
③ 原溶液中加BaCl2溶液不产生沉淀。
④ 原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
回答下列问题:
(1) 试分析原溶液中一定含有的离子是 ,一定不含有的离子
是 , 可能含有的离子是 。
(2) 有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”) ,
并说明理由 。
24.(共8分)“绿色试剂”双氧水可作为矿业废液消毒剂,消除采矿业废液中的氰化物
(如KCN),其化学方程式为:KCN+H2O2+ H2O===A+NH3↑
(1)生成物A的化学式为______________________;
(2)在标准状况下有0.448L氨气生成,则转移的电子数为__________________个;
(3)反应中被氧化的元素为_______________;
(4)H2O2被称为绿色氧化剂的理由是_______________________________。
五、(本题包括2小题,共16分)
25.(共6分)将BaCl2·xH2O的晶体2.44g溶于水,配成100mL溶液,取此溶液25mL,与50mL0.1 mol·L-1的AgNO3溶液相作用,刚好把Cl-离子沉淀完全。求:
(1)2.44gBaCl2·xH2O的物质的量。
(2)BaCl2·xH2O的相对分子质量。
(3)BaCl2·xH2O中的x值。
26.(共10分)生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二
氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红热CuO粉末的硬质
玻璃管,发生的反应为:CH4+4CuOCO2+2H2O+4Cu。当甲烷完全反应后,硬质玻
璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生
成沉淀8.5g。
(1)硬质玻璃管的质量减轻4.8g是 的质量,参加反应的氧化铜的物质的量为
(2)原混合气体中甲烷的物质的量是 。
(3)原混合气体中氮气的体积分数为多少?(写出计算过程)
江苏省海门中学第一学期高一期中考试
化学答题纸
三、(本题包括2小题,共17分)
21.(共9分)
(1)_____________________ (2)_____________________
(3)_____________________ (4)_____________________
(5)_____________________ (6)_____________________
22.(共8分)
(1)_____________________
(2)_____________________
(3)_____________________ ____________________ _____________________
(4)_____________________
四、(本题包括2小题,共17分)
23.(共9分)
(1)_____________________ ____________________ _____________________
(2)_____________________
____________________________________________________________________
24.(共8分)
(1)_____________________
(2)_____________________
(3)_____________________
(4)______________________________________________________
五、(本题包括2小题,共16分)
25.(共6分)(1)
(2)
(3)
26.(共10分)
(1)_________________________________________
__________________________________________
(2)_____________________
(3)
参考答案
1~5:A、C、 B、 D 、C 6~10:D、B 、C 、C 、A
11~15:C、CD、B、B、B 16~20:C、BD、C、AD、B
21.(共9分)
HNO3(2分) Na2CO3(1分)
Ba(NO3)2(2分) Na2SO4 (1分)
AgNO3(2分) NaCl(1分)
22.(共8分)
(1)A(1分)
(3)托盘天平、胶头滴管、1000 mL容量瓶(3分)
(4)BD(2分)
23. (共9分)
(1)Mg2+、NH4+、Cl-(3分); CO32-、SO42-(2分); Na+ 、 K+(2分)
(写对一个得一分,写错一个扣一分,扣到该空零分为止)
(2)可以(1分) 溶液显电中性有阳离子存在必有阴离子存在(1分)
24.(共8分)
(1)KHCO3(2分) (2)0.04NA (2分)
(3)C(2分) (4)产物为H2O,无污染(2分)
25.(共6分)
(1) 0.01mol(2分) (2) 244(2分) (3) 2 (2分)
26. (共10分)
(1)氧化铜中氧元素的质量(2分) ,0.3mol(2分)(2)0.075mol (2分)
(3)5.56%(4分)