- 937.00 KB
- 2021-04-14 发布
技能强化专练(七) 电化学
[授课提示:对应学生用书第 109 页]
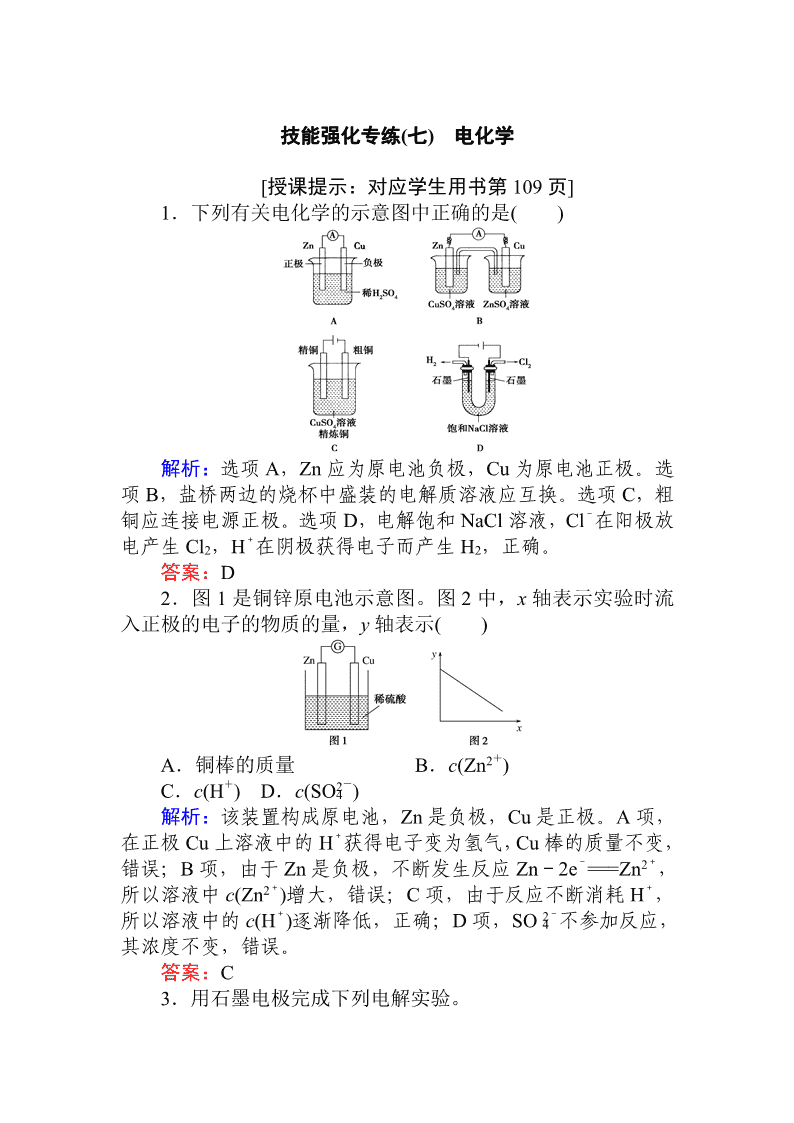
1.下列有关电化学的示意图中正确的是( )
解析:选项 A,Zn 应为原电池负极,Cu 为原电池正极。选
项 B,盐桥两边的烧杯中盛装的电解质溶液应互换。选项 C,粗
铜应连接电源正极。选项 D,电解饱和 NaCl 溶液,Cl-在阳极放
电产生 Cl2,H+在阴极获得电子而产生 H2,正确。
答案:D
2.图 1 是铜锌原电池示意图。图 2 中,x 轴表示实验时流
入正极的电子的物质的量,y 轴表示( )
A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO2-
4 )
解析:该装置构成原电池,Zn 是负极,Cu 是正极。A 项,
在正极 Cu 上溶液中的 H+获得电子变为氢气,Cu 棒的质量不变,
错误;B 项,由于 Zn 是负极,不断发生反应 Zn-2e-===Zn2+,
所以溶液中 c(Zn2+)增大,错误;C 项,由于反应不断消耗 H+,
所以溶液中的 c(H+)逐渐降低,正确;D 项,SO 2-
4 不参加反应,
其浓度不变,错误。
答案:C
3.用石墨电极完成下列电解实验。
实验一 实验二
装置
现象 a、d 处试纸变蓝;b 处变红,
局部褪色;c 处无明显变化
两个石墨电极附近有气泡产
生;n 处有气泡产生……
下列对实验现象的解释或推测不合理的是( )
A.a、d 处:2H2O+2e-===H2↑+2OH-
B.b 处:2Cl--2e-===Cl2↑
C.c 处发生了反应:Fe-2e-===Fe2+
D.根据实验一的原理,实验二中 m 处能析出铜
解析:根据 a、d 处试纸变蓝,可判断 a、d 两点都为电解池
的阴极,发生的电极反应为 2H2O +2e-===H2↑+2OH-,A 选
项正确;b 处变红,局部褪色,说明 b 为电解池的阳极,2Cl--
2e-===Cl2↑,氯气溶于水生成盐酸和次氯酸:Cl2+H2O===HCl
+HClO,HCl 溶液显酸性,HClO 具有漂白性,B 选项不正确;
c 处为阳极,铁失去电子生成亚铁离子,发生的电极反应为 Fe
-2e-===Fe2+,C 选项正确;实验一中 ac 形成电解池,db 形成
电解池,所以实验二中也形成电解池,铜珠的左端为电解池的阳
极,铜失电子生成铜离子,m、n 是铜珠的右端,为电解池的阴
极,开始时产生气体,后来铜离子得到电子生成单质铜,故 D
选项正确。
答案:B
4.
研究电化学腐蚀及防护的装置如右图所示。下列有关说法错
误的是( )
A.d 为石墨,铁片腐蚀加快
B.d 为石墨,石墨上电极反应为:O2+2H2O+4e-===4OH
-
C.d 为锌块,铁片不易被腐蚀
D.d 为锌块,铁片上电极反应为:2H++2e-===H2↑
解析:A.由于活动性:Fe>石墨,所以铁、石墨及海水构成
原电池,Fe 为负极,失去电子被氧化变为 Fe2+进入溶液,溶解
在海水中的氧气在正极石墨上得到电子被还原,铁的腐蚀比没有
形成原电池时的速率快,正确。B.d 为石墨,由于是中性电解质,
所以发生的是吸氧腐蚀,石墨上氧气得到电子,发生还原反应,
电极反应为:O2+2H2O+4e-===4OH-,正确。C.若 d 为锌块,
则由于金属活动性:Zn>Fe,Zn 为原电池的负极,Fe 为正极,
首先被腐蚀的是 Zn,铁得到保护,铁片不易被腐蚀,正确。D.d
为锌块,由于电解质为中性环境,发生的是吸氧腐蚀,铁片上电
极反应为:O2+2H2O+4e-===4OH-,错误。
答案:D
5.现有阳离子交换膜、阴离子交换膜、石墨电极和如图所
示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解
Na2SO4 溶液生产 NaOH 溶液和 H2SO4 溶液。下列说法中正确的
是( )
A.b 是阳离子交换膜,允许 Na+通过
B.从 A 口出来的是 NaOH 溶液
C.阴极反应式为 4OH--4e-===2H2O+O2↑
D.Na2SO4 溶液从 G 口加入
解析:A 项,右边电极是阴极,氢离子放电,b 是阳离子交
换膜,允许 Na+通过,正确;B 项,左边电极是阳极,阳极是氢
氧根放电,从 A 口出来的是硫酸溶液,错误;C 项,阴极是氢离
子得到电子,错误;D 项,根据分析可知 Na2SO4 溶液从 F 口加
入,错误。
答案:A
6.如图 1 为甲烷和 O2 构成的燃料电池示意图,电解质为
KOH 溶液,图 2 为电解 AlCl3 溶液的装置,电极材料均为石墨。
用该装置进行实验,反应开始后观察到 x 电极附近出现白色沉
淀。下列说法正确的是( )
A.A 处通入的气体为 CH4,电极反应式为 CH4+10OH--
8e-===CO2-
3 +7H2O
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O=====
电解
Cl2↑
+H2↑+2OH-
C.图 1 中电解质溶液的 pH 增大
D.电解池中 Cl-向 x 极移动
解析:A 项,反应开始后观察到 x 电极附近出现白色沉淀,
说明 x 电极上氢离子放电,x 电极附近生成氢氧根离子,所以 x
电极是阴极,y 电极是阳极,则 a 是负极,b 是正极,负极上是
燃料失电子发生氧化反应,电极反应式为 CH4+10OH--8e-
===CO2-
3 +7H2O,正确;B 项,电解池中电池反应式为 2AlCl3
+6H2O=====
电解
3Cl2↑+3H2↑+2Al(OH)3↓,错误;C 项,原电池
中,负极:CH4+10OH--8e-===CO2-
3 +7H2O,正极:2O2+4H2O
+8e-===8OH-,总方程式:CH4+2O2+2OH-===CO2-
3 +3H2O,
消耗 OH-,所以溶液的 pH 值变小,错误;D 项,电解池中 Cl-
向 y 极移动,错误。
答案:A
7.向
新型燃料电池的两极分别通入 CH4 和空气,其中固体电解质
是掺杂了 Y2O3 的 ZrO3 固体,它在高温下能传导 O2-。图中滤纸
用含有酚酞的氯化钠溶液浸泡过,c、d、e、f 均为惰性电极,工
作后 e 极周围变红。下列叙述正确的是( )
A.c 极为正极,A 处通入甲烷气体
B.d 极的反应式为 O2+2H2O+4e-===4OH-
C.固体电解质中 O2-由 d 极向 c 极移动
D.e 极上发生氧化反应,pH 增大
解析:本题是用甲烷燃料电池电解氯化钠溶液,根据 e 极周
围变红色,表明该电极是阴极,发生还原反应:2H2O+2e -
===H2↑+2OH-,D 错误,则 c 是负极,A 处通入甲烷,A 错误;
d 极是正极,发生反应:O2+4e-===2O2-,B 错误;原电池中阴
离子移向负极,C 正确。
答案:C
8.某化学小组构想将汽车尾气(NO、NO2)转化为重要的化
工原料 HNO3,其原理如图所示,其中 A、B 为多孔材料。下列
说法正确的是( )
A.电解质溶液中电流的方向由 B 到 A,电子的流向与之相
反
B.电极 A 表面反应之一为 NO-3e-+2H2O===NO-
3 +4H+
C.电极 B 附近的 c(NO-
3 )增大
D.该电池工作时,每转移 4 mol 电子,生成 22.4 L O2
解析:该电池的工作原理(以 NO 为例)为 4NO+3O2 +
2H2O===4HNO3,则 NO 发生了氧化反应,故 A 极为负极,B 极
为正极。电子只能通过外电路,其流向为从 A 到 B,A 项错误;
负极反应(以 NO 为例)为 NO-3e-+2H2O===NO-
3 +4H+,B 项正
确;原电池中阴离子(NO-
3 )向负极附近移动,另外,电极反应 O2
+4e-+4H+===2H2O,使 c(NO-
3 )减小,C 项错误;电池工作时,
每转移 4 mol 电子,消耗 1 mol O2,在标准状况下 O2 的体积为
22.4 L,D 项错误。
答案:B
9.
一种碳纳米管能够吸附氢气,可作充电电池(如图所示)的碳
电极,该电池的电解质溶液为 6 mol·L-1KOH 溶液,下列说法中
正确的是( )
A.充电时将碳电极与电源的正极相连
B.充电时阴极发生氧化反应
C.放电时镍电极反应为:NiOOH+H2O+e-===Ni(OH)2+
OH-
D.放电时碳电极反应为:2H++2e-===H2↑
解析:A 项,碳纳米管能够吸附氢气,可作充电电池的负极,
放电时氢气发生氧化反应,故充电时该电极与外接电源的负极相
连,错误;B 项,充电时阳极发生氧化反应,阴极发生还原反应,
错误;C 项,放电时镍电极为正极,得到电子,发生还原反应,
其电极反应为:NiOOH+H2O+e-===Ni(OH)2+OH-,正确;D
项,放电时碳电极反应为:H2-2e-+2OH-===2H2O,错误。
答案:C
10.我国古代青铜器工艺精湛,有很高的艺术价值和历史价
值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护
具有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原
理示意图。下列说法不正确的是( )
A.腐蚀过程中,负极是 a
B.正极反应是 O2+4e-+2H2O===4OH-
C.若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 0.224
L(标准状况)
D.环境中的 Cl-扩散到孔口,并与正极反应产物和负极反
应产物作用生成多孔粉状锈 Cu2(OH)3Cl,其离子方程式为 2Cu2
++3OH-+Cl-===Cu2(OH)3Cl↓
解析:C 项,n[Cu2(OH)3Cl]= 4.29 g
214.5 g·mol-1
=0.02 mol,根
据转移电子数得 n(O2)=0.02 mol×2×2
4
=0.02 mol,则理论上耗
氧体积为 0.448 L(标准状况),故 C 错误。
答案:C
11.某模拟“人工树叶”电化学实验装置如图所示,该装置
能将 H2O 和 CO2 转化为 O2 和燃料 C3H8O。下列说法正确的是
( )
A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从 b 极区向 a 极区迁移
C.每生成 1 mol O2,有 44 g CO2 被还原
D.a 电极的反应为 3CO2+18H+-18e-===C3H8O+5H2O
解析:结合装置图可知该装置为电解装置,模拟“人工树
叶”,故为电能转化为化学能,A 项错误;b 极连接电源的正极,
为阳极,在电解池中 H+向 a 极(阴极)区移动,B 项正确;右侧
H2O→O2 发生的是氧化反应,每生成 1 mol O2,转移 4 mol 电子,
C3H8O中碳元素的化合价是-2,3CO2→C3H8O,转移18 mol电子,
故生成 1 mol O2 消耗 2
3mol CO2,C 项错误;a 电极发生的是还原
反应:3CO2+18H++18e-===C3H8O+5H2O,D 项错误。
答案:B
12.金属及其化合物在国民经济发展中起着重要作用。
(1)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工
艺的中间过程会发生反应:2Cu2O+Cu2S===6Cu+SO2,该反应
的氧化剂是________,当生成 19.2 g Cu 时,反应中转移的电子
为________mol。铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜
锈的主要成分为 Cu2(OH)2CO3(碱式碳酸铜)。该过程中负极的电
极 反 应 式 为
_______________________________________________________
_________________
___________________________________________________
_____________________。
(2)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作
为两个电极的反应物,固体 Al2O3 陶瓷(可传导 Na+)为电解质,
其原理如图所示:
①根据下表数据,请你判断该电池工作的适宜温度应控制在
________。
物质 Na S Al2O
3
熔点
/℃ 97.8 115 2 050
沸点
/℃ 892 444.
6 2 980
a.100℃以下 b.100℃~300℃
c.300℃~350℃ d.350℃~2 050℃
②放电时,电极 A 为________极,S 发生________反应。
③放电时,内电路中 Na+的移动方向为________(填写“从 A
到 B”或“从 B 到 A”)。
④充电时,总反应为 Na2Sx===2Na+Sx(3