- 292.00 KB
- 2021-04-14 发布
2019学年第二学期高一第2次月考化学试卷
一、单选题
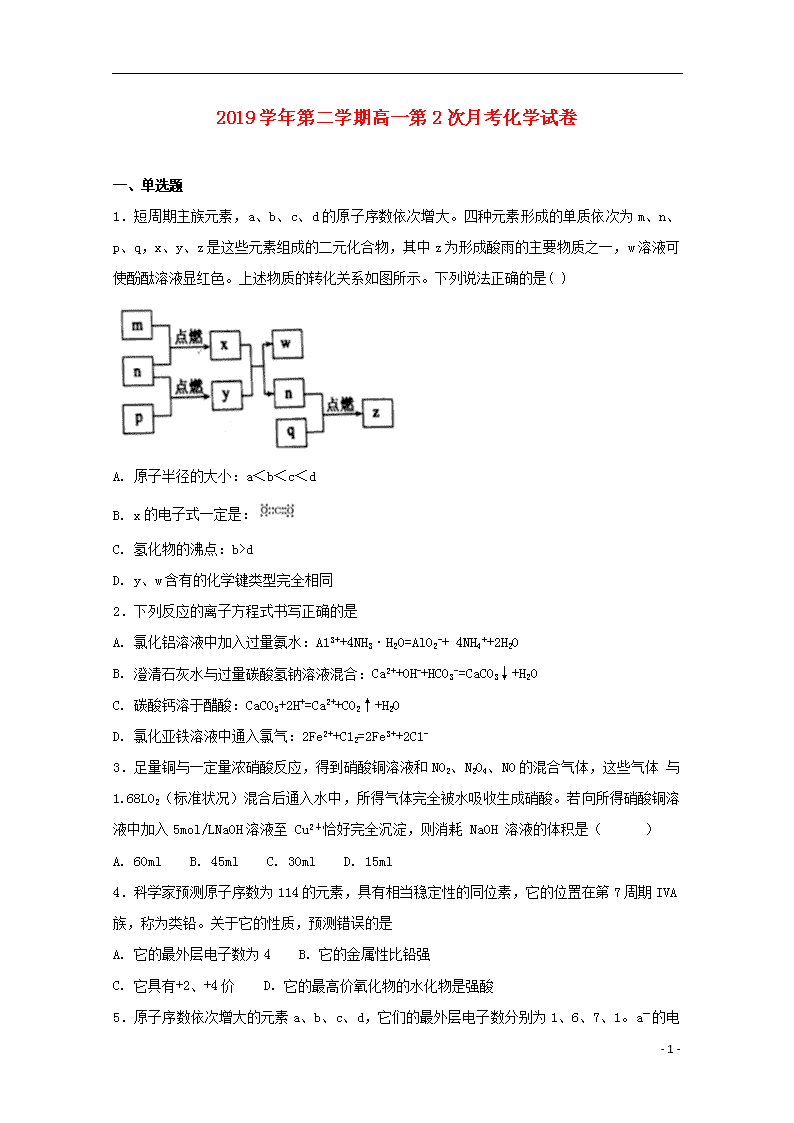
1.短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,w溶液可使酚酞溶液显红色。上述物质的转化关系如图所示。下列说法正确的是( )
A. 原子半径的大小:a<b<c<d
B. x的电子式一定是:
C. 氢化物的沸点:b>d
D. y、w含有的化学键类型完全相同
2.下列反应的离子方程式书写正确的是
A. 氯化铝溶液中加入过量氨水:A13++4NH3·H2O=AlO2-+ 4NH4++2H2O
B. 澄清石灰水与过量碳酸氢钠溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
C. 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O
D. 氯化亚铁溶液中通入氯气:2Fe2++C12=2Fe3++2C1-
3.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体 与1.68LO2(标准状况)混合后通入水中,所得气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至 Cu2+恰好完全沉淀,则消耗 NaOH 溶液的体积是( )
A. 60ml B. 45ml C. 30ml D. 15ml
4.科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是
A. 它的最外层电子数为4 B. 它的金属性比铅强
C. 它具有+2、+4价 D. 它的最高价氧化物的水化物是强酸
5.原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-
- 9 -
的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A. 元素的非金属性次序为c>b>a
B. a和其他3种元素均能形成共价化合物
C. d和其他3种元素均能形成离子化合物
D. 元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
6.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
①洗气瓶中产生的沉淀中有碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现
A. ①② B. ③④ C. ①④ D. ②③
7.下列有关铜与浓硝酸反应的说法中错误的是
A. HNO3是氧化剂,NO2是还原产物
B. 若2 mol HNO3被还原,则反应中一定生成22.4 L NO2气体
C. 参加反应的硝酸中,被还原和未被还原的硝酸的物质的量之比是1∶1
D. 硝酸在反应中既表现了强氧化性,又表现了酸性
8.短周期元素X、Y、Z、W、Q在周期表中的位置如表所示,其中W的气态氢化物摩尔质量为34 g/mol,Y的最低价氢化物为非电解质.则下列说法中正确的是( )
X
Y
Z
W
Q
A. X的最低价氢化物水溶液显酸性
- 9 -
B. Q单质能溶于水,且水溶液须用棕色细口瓶盛装
C. Na与Y能形成化合物Na2Y2,且与水反应后溶液呈碱性
D. 阴离子还原性:W>Q
9.W、R、X、Y、Z是原子序数依次增大的短周期主族元素。Y原子半径在短周期主族元素中最大。W与Y同主族,X与Z同主族。R原子最外层电子数比内层电子数多3,W、Y原子的电子数总和与X、Z原子的电子数总和之比为1∶2。下列说法正确的是
A. 原子半径: r(Z)>r(X)>r(R)>r(W)
B. X与Y形成化合物中可能既有离子键又有共价键
C. X的简单气态氢化物的热稳定性比Z的弱
D. 由W、R、X三种元素组成的化合物只能是酸或碱
10.下列说法正确的是
A. 固态CH4与NH4Cl都属于分子晶体
B. MgCl2中既有离子键又有共价键
C. 冰熔化时,分子中氢键和H﹣O键发生断裂
D. 熔沸点由高到低的顺序是金刚石>NaCl>H2O
11.下列关于浓硝酸的说法不正确的是
A. 光照易分解
B. 露置于空气中溶液浓度降低
C. 能与碳反应说明其具有强氧化性
D. 常温下铜在浓硝酸中发生钝化
12.X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH4+、CO32−、Cl−、SO32−、SO42−。某同学为确定其成分,设计并完成以下实验(不考虑水解,所加试剂均足量):
下列说法正确的是
- 9 -
A. X溶液中一定存在Na+、SO32−、SO42−、CO32−
B. X溶液中一定存在NH4+、Na+、SO42−,至少含有Fe3+、Fe2+离子中的一种
C. 取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+
D. X溶液中一定含有Cl−,且c(Cl−)≥0.1mol·L−1
13.一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s) =Ag(s)+Cl(AgCl) [Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着 Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即恢复至初始状态。下列说法正确的是
A. 光照时,电流由 铂流向银
B. 光照时,Pt 电极发生的反应为 2Cl-+2e-= Cl2
C. 光照时,Cl-向 Ag 电极移动
D. 光照时,电池总反应:AgCl (s)+Cu+(aq)=Ag(s)+Cu2+(aq)+Cl-(aq)
14.下列离子方程式书写正确的是
A. 碘化亚铁中通入过量氯气:2Fe2+ + 2I- + 2Cl2 = 2Fe3+ + I2 + 4Cl-
B. 碳酸钠溶液中通入过量氯气:CO32-+Cl2 = CO2↑+Cl-+ClO-
C. NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2+ +OH-=BaSO4↓+H2O
D. 金属钠投入硫酸镁溶液中:2Na + 2H2O + Mg2+ = 2Na+ + H2↑ + Mg(OH)2↓
15.下列实验中能证明一种气体为SO2的是
①通入CaCl2溶液,无现象,后通入氨气,溶液变浑浊 ②通入H2S饱和溶液中有浅黄色浑浊③和氯气以1:1的物质的量比通入品红溶液,结果溶液不褪色 ④通入足量Ba(OH)2溶液,有白色沉淀生成⑤通入溴水中使溴水褪色,再滴加BaCl2溶液有白色沉淀产生,该沉淀难溶于稀硝酸。
A. ①③⑤能证明 B. ④⑤能证明
C. ③⑤能证明 D. 仅⑤能证明
16.利用如图所示装置进行下列四组实验,不能得到相应实验结论的是
①
②
③
实验结论
- 9 -
选项
A
浓硫酸
Na2SO3
酸性KMnO4溶液变浅
SO2有还原性
B
浓盐酸
KMnO4
FeBr2溶液变为黄色
氧化性:Cl2 >Br2
C
稀硫酸
碳酸钠
CaCl2溶液无明显变化
CO2不与CaCl2反应
D
浓硫酸
蔗糖
溴水褪色
浓硫酸具有脱水性、强氧化性
A. A B. B C. C D. D
17.甲、乙两种非金属:①甲的氧化物对应的水化物酸性比乙的氧化物对应的水化物酸性强;②甲比乙更容易与氢气化合;③甲单质能与乙的简单阴离子发生置换反应;④与金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是
A. ①②③④ B. ②③ C. ②③④ D. ②③④⑤
18.下列判断正确的是
A. 图①:当CH4与Cl2体积比为1:2,维持足够长反应时间,CH4可全部变成CCl4
B. 图②:碎瓷片的作用与蒸馏实验中的碎瓷片作用不同
C. 图③:烷烃、烯烃、炔烃的单一物质及同类混合物含碳量随C原子数的变化曲线分别为a、b、c
D. 图④:点a代表的物质是PH3
- 9 -
19.下列离子方程式书写正确的是( )
A. 向澄清石灰水中通入足量二氧化碳:2OH‾+CO2===+H2O
B. 氧化钠投入水中发生反应:+H2O===2OH‾
C. 醋酸溶液滴入到NaOH溶液中:CH3COOH+OH‾===CH3COO‾+H2O
D. 铁和稀盐酸反应制氢气:2Fe+6H+===2Fe3++3H2↑
20.在密闭容中加入2.0 mol SO2和1.0 mol O2,一定条件下发生如下反应2SO2+O22SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol
n(O2)/mol
n(SO3)/mol
A
2.0
1.0
0
B
0.20
0.10
1.80
C
1.0
0.8
1.0
D
0
0
2.0
A. A B. B C. C D. D
二、综合题
21.雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是_____。(用元素符号回答)
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
- 9 -
①由图1可知SCR技术中的氧化剂为:_________________。
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO)/c(NO2)对应的脱氮率如图2所示,效果最佳的c(NO)/ c(NO2)=_________。
(3)硝酸厂常用如下烧碱吸收法处理氦氧化物(NO与NO2)尾气。氮氧化物(NO与NO2)用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。已知反应后溶液中含有0.35mo1NaNO2。则尾气中NO与NO2的物质的量之比为______。(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O、NO+NO2+2NaOH=2NaNO2+H2O)
(4)现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸[假设反应中稀硝酸的还原产物只有NO),产生气体在标准状况下的体积与剩余固体的质量如下表:
硝酸体枳(mL)
100
200
300
400
剩余固体(g)
18.0
9.6
0
0
放出气体的体积(mL)
2240
4480
6720
计算原混合物中铁和铜的物质的量比为_______________。
22.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
(1)写出该反应的化学方程式________________________________。
- 9 -
(2)计算反应开始到10s,用X表示的反应速率是______________。
(3)下列叙述中能说明上述反应达到平衡状态的是______________。
a.当X与Y的反应速率之比为1:1
b.混合气体中X的质量分数保持不变
c.X、Y、Z的浓度之比为1:1:2
(4)当反应达到平衡时,用Y表示的正反应速率v正(Y)与用Z表示的逆反应速率v逆(Z)的关系式是_________________。
(5)为使该反应的反应速率增大,可采取的措施是_______。
a.适当降低温度 b.扩大容器的体积 c.充入一定量Z
- 9 -
参考答案
CDADB BBDBD DDDDD BBBCB
21. O NO、NO2 1:1 1:4 2:1
22. X (g)+Y(g)2Z(g) 0.0395 mol•(L•s)﹣1 b 2v正(Y)= v逆(Z) c
- 9 -
相关文档
- 2020年湖南省普通高中学业水平合格2021-04-14 12:08:327页
- 2020版高中历史 第7单元 苏联的社2021-04-14 12:08:243页
- 2018-2019学年湖北省宜昌市部分示2021-04-14 12:06:048页
- 高中毕业自我鉴定700字2021-04-14 12:05:163页
- 2020高中地理 第二章 旅游资源2021-04-14 12:05:146页
- 2020高中历史 第三单元 各国经济体2021-04-14 12:04:527页
- 2020-2021学年高中人教版历史必修32021-04-14 12:02:178页
- 2018年人教版高中语文必修5《说“2021-04-14 12:01:184页
- 2019版高中地理《金版教程》一轮总2021-04-14 12:00:5131页
- 高中生入党积极分子10月思想汇报152021-04-14 11:58:342页