- 482.50 KB
- 2021-04-13 发布
- 1 -
2019 学年高一化学下学期期末考试试题
可能用到的相对原子质量: H-1 C-12 O-16 Si-28
一、选择题(本题共 16 小题,每小题 3 分,共 48 分。只有一个选项符合题意)
1、空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的
支持,下列措施不利于“蓝天工程”建设的是
A.推广使用燃煤脱硫技术,防治污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
2、用 NA 表示阿伏伽德罗常数的值。下列叙述正确的是
A.22.4L 乙烷中含有的共价键数为 7NA 个
B.常温下,28g 乙烯和丙烯的混合物中总原子数为 6NA 个
C.密闭容器中 2 molNO 与 1molO2 充分反应,产物的分子数为 2NA
D.标准状况下,11.2L 二氯甲烷(CH2Cl2)所含的分子数为 0.5NA
3、下列说法正确的是
A.油脂属于酯类化合物,酯类在碱性条件下的水解叫皂化反应
B.用电子式表示氯化氢分子的形成过程:
C.浓硝酸溅在皮肤上,使皮肤呈黄色是由于浓硝酸和蛋白质发生了颜色反应
D.工业上常用电解熔融 AlCl3 的方法来制备单质铝
4、已知 A2+、B+、C3-、D-是第三周期元素的四种离子。下列叙述中正确的是
A.四种离子都具有相同的电子层结构
B.原子半径:r(D)>r(C)>r(A)>r(B)
C.离子半径:r(B+)>r(A2+)>r(C-)>r(D-)
D.B、D 两元素的最高价氧化物的水化物在溶液中反应的离子方程式可表示为 H++OH-=H2O
5、R 原子的质量数为 Y,mgR2-中含有电子 Xmol,则 R 原子核内中子数为
A.
m
mXYmY 2 B. Y-X+2 C.
m
mXYmY 2 D. Y-X-2
6、下列条件的改变,一定会同时影响化学反应速率和化学平衡的是
A.浓度 B.温度 C.压强 D.催化剂
7、W、X、Y、Z 为短周期元素,W 的原子中只 1 个电子,X2-和 Y-的电子层结构相同,Z 与 X 同
- 2 -
族。下列叙述不正确的是
A.Y 的原子半径是这些元素中最大的
B.Z 与 W 形成的化合物的溶液呈弱酸性
C.W 与其他三种元素形成的二元化合物中其化合价均为+1
D.X 与其他三种元素均可形成至少两种二元化合物
8、2003 年, TUPAC(国际纯粹与应用化学联合会)推荐原子序数为 110 的元素的符号为 Ds,
以纪念该元素的发现地( Darmstadt,德国)。下列关于 Ds 的说法不正确的是
A.Ds 原子的电子层数为 7 B.Ds 属于第 VⅢ族
C.Ds 为金属元素 D.Ds 原子的质量数为 110
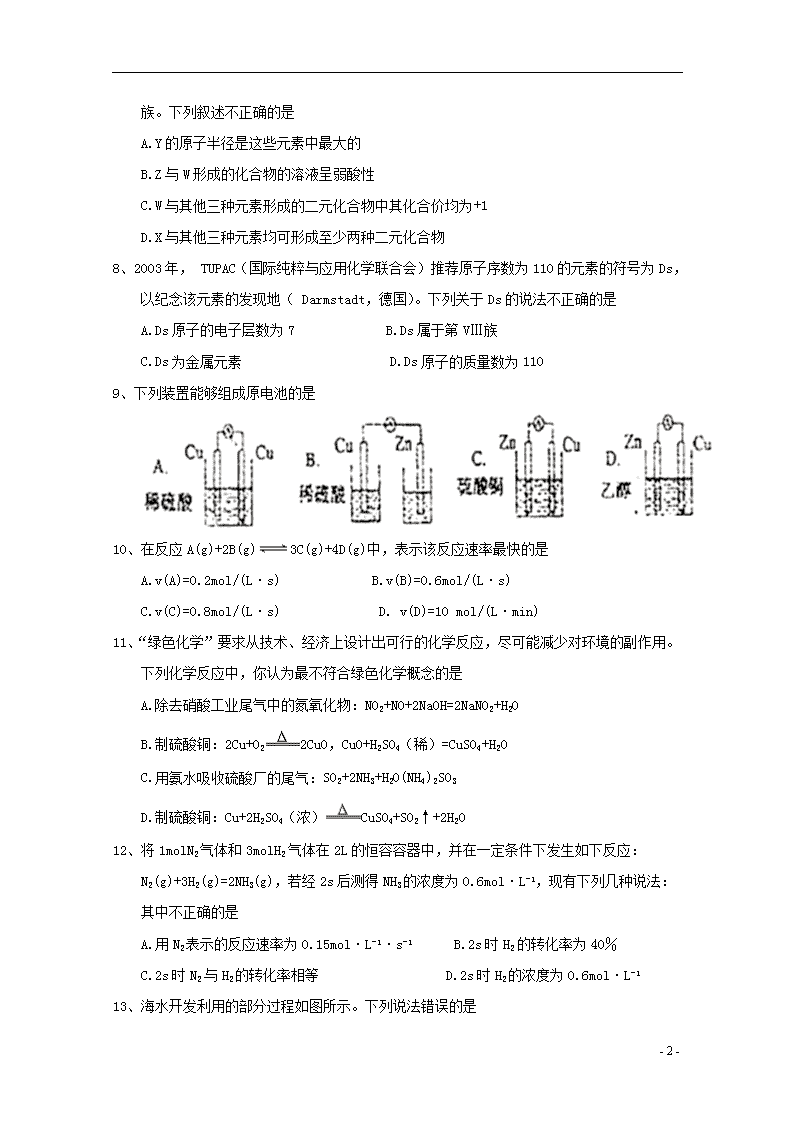
9、下列装置能够组成原电池的是
10、在反应 A(g)+2B(g) 3C(g)+4D(g)中,表示该反应速率最快的是
A.v(A)=0.2mol/(L·s) B.v(B)=0.6mol/(L·s)
C.v(C)=0.8mol/(L·s) D. v(D)=10 mol/(L·min)
11、“绿色化学”要求从技术、经济上设计出可行的化学反应,尽可能减少对环境的副作用。
下列化学反应中,你认为最不符合绿色化学概念的是
A.除去硝酸工业尾气中的氮氧化物:NO2+NO+2NaOH=2NaNO2+H2O
B.制硫酸铜:2Cu+O2 2CuO,CuO+H2SO4(稀)=CuSO4+H2O
C.用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O(NH4)2SO3
D.制硫酸铜:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
12、将 1molN2 气体和 3molH2 气体在 2L 的恒容容器中,并在一定条件下发生如下反应:
N2(g)+3H2(g)=2NH3(g),若经 2s 后测得 NH3 的浓度为 0.6mol·L-1,现有下列几种说法:其
中不正确的是
A.用 N2 表示的反应速率为 0.15mol·L-1·s-1 B.2s 时 H2 的转化率为 40%
C.2s 时 N2 与 H2 的转化率相等 D.2s 时 H2 的浓度为 0.6mol·L-1
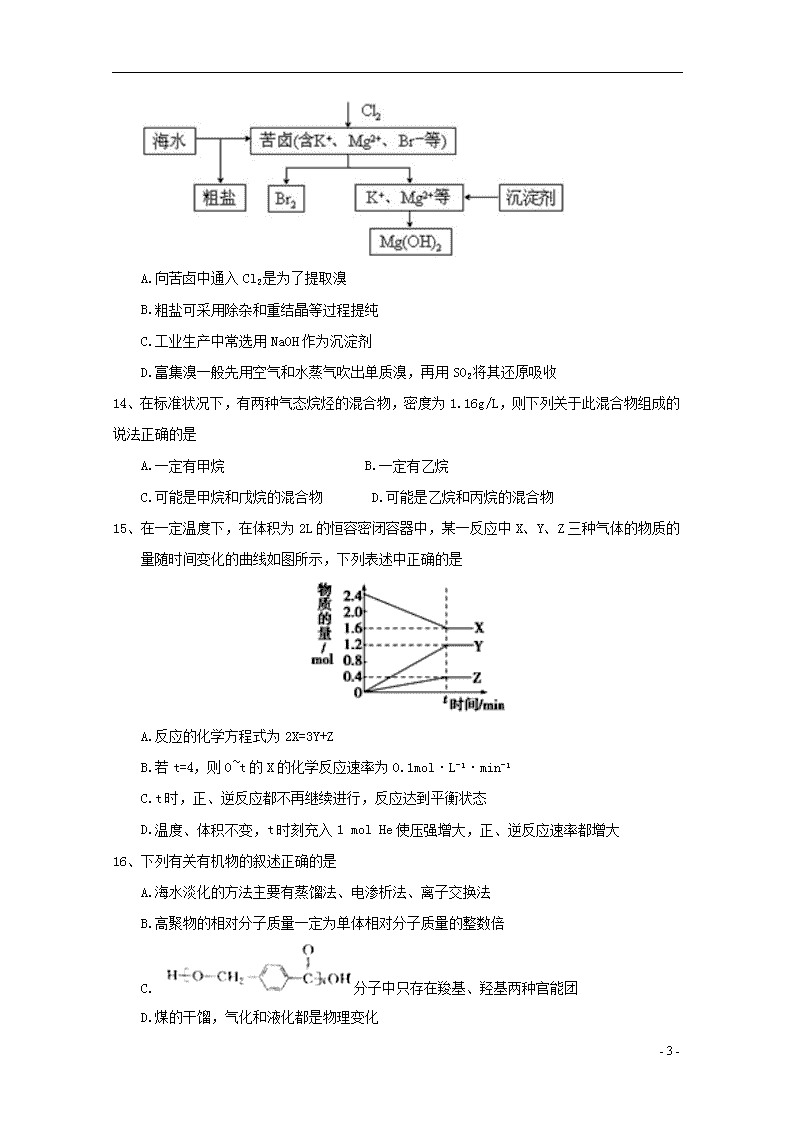
13、海水开发利用的部分过程如图所示。下列说法错误的是
- 3 -
A.向苦卤中通入 Cl2 是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用 NaOH 作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收
14、在标准状况下,有两种气态烷烃的混合物,密度为 1.16g/L,则下列关于此混合物组成的
说法正确的是
A.一定有甲烷 B.一定有乙烷
C.可能是甲烷和戊烷的混合物 D.可能是乙烷和丙烷的混合物
15、在一定温度下,在体积为 2L 的恒容密闭容器中,某一反应中 X、Y、Z 三种气体的物质的
量随时间变化的曲线如图所示,下列表述中正确的是
A.反应的化学方程式为 2X=3Y+Z
B.若 t=4,则 0~t 的 X 的化学反应速率为 0.1mol·L-1·min-1
C.t 时,正、逆反应都不再继续进行,反应达到平衡状态
D.温度、体积不变,t 时刻充入 1 mol He 使压强增大,正、逆反应速率都增大
16、下列有关有机物的叙述正确的是
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.高聚物的相对分子质量一定为单体相对分子质量的整数倍
C. 分子中只存在羧基、羟基两种官能团
D.煤的干馏,气化和液化都是物理变化
- 4 -
二、非选择题(共 52 分,每空 2 分)
17、按要求填写:(8 分,每空 2 分)
(1)含有 12 个氢原子的烷烃分子式__________________。其同分异构体共有________
种;
(2)除去乙酸乙酯中含有的少量乙酸可用____________(填试剂名称);
(3)己烯、乙酸和葡萄糖组成的混合物中,氧元素的质量分数是 32%,则氢元素的质量
分数为__________________________;
18、(12 分,每空 2 分)有 X、Y、Z、W 四种短周期元素,原子序数依次增大。X 元素原子的
半径最小。Z、W 在周期表中处于邻位置,它们的单质在通常状况下均为无色气体。Y 原
子的最外层电子数是次外层子数的 2 倍。请回答:
(1)Z2 的电子式为___________,YW2 的结构式为____________。
(2)将 X2、W2 按上图所示通入某燃料电池中,其中,b 电极的电极反应式
为 ________ 。若有 16gW2 参加反应,转移的电子数
是 。
(3)由 X、Y、Z、W 四种元素组成的无机酸酸式盐_______(化学式),与足量的 NaOH 溶
液在加热条件下反应的离子方程式
为 _________________________ 。
19、(8 分,每空 2 分)最近中央电视二台报道,市场抽查吸管合格率较低,存在较大的安全
隐患,其中塑化剂超标是一个主要方面,塑化剂种类繁多,其中邻苯二甲酸二酯是主要
的一大类, (代号 DMP)是一种常用的酯类化剂,其蒸气对氢气的相对密度
为 97。工业上生产 DMP 的流程如图所示:
已知:R-X+NaOH R-OH+NaX
(1)上述反应⑤的反应类型为___________________。
(2)D 中官能团的名称为___________________。
(3)DMP 的结构简式为___________________。
(4)B→C 的化学方程式为_____________________________。
- 5 -
20、(12 分,每空 2 分)某化学学习小组采用下图所示装置,对浓硝酸与木炭的反应进行探究
(已知:4HNO3 4NO2↑+O2↑+2H2O)。
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,伸入三颈烧瓶
中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈烧瓶中气体的颜色为___________,产生该
气体的化学方程式是_____________________________。
(2)装置 C 中盛有足量 Ba(OH)2 溶液,炽热的木炭与浓硝酸反应后可观察到 C 中出现白
色沉淀,该白色沉淀为_____________(填化学式)。
(3)装置 B 的作用是______________________________________。
(4)装置 D 中收集到了无色气体,部分同学认为是 NO,还有部分同学认为是 O2。
①下列对该气体的检验方法不合适的是________________。
A.向装置 D 中通入 O2,观察集气瓶内气体的颜色变化
B.将湿润的蓝色石蕊试纸伸入集气瓶内,观察蓝色石蕊试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果 D 中集气瓶中收集的无色气体是氧气,则氧气的来源是
___________________________。
21、(12 分,每空 2 分)碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良在工业生产
和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由 SiO2 与过量焦炭在 1300~1700℃的氮
气流中反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g),已知 60gSiO2 完全反应时
放出 530.4kJ 的能量,则该反应每转移 1mole-,可放出的热量为___________________。
(2)某研究小组现将三组 CO(g)与 H2O(g)混合气体分别通入体积为 2L 的恒容密闭容器中,
一定条件下发生反应:CO(g)+H2O(g)==CO2(g)+H2(g),得到如下数据:
实验组 温度/℃ 起始量/mol 平衡量/mol 达平衡所需时间/min
- 6 -
1 650 2 4 0.5 1.5 5
2 900 1 2 0.5 0.5 _______
①实验 1 中,前 5min 的反应速率 v(H2O)=_____________。
②下列能判断实验 2 已经达到平衡状态的是______________________。
a.混合气体的密度保持不变 b.容器内 CO、H2O、CO2、H2 的浓度比不再变化
c.容器内压强不再变化 d..容器中气体的平均相对分子质量不随时间而变
化
e. v 正(CO)=v 逆(H2O)
③若实验 3 的容器是绝热恒容的密闭容器,实验测得 H2O(g)的转化率 H2O%随时间变化的
示意图如左上图所示,b 点 v 正_________v 逆(填“<”、“=”或“>”)
(3)利用 CO 与 H2 可直接合成甲醇,右上图是由“甲醇(CH3OH)一空气”形成的绿色燃
料电池的工作原理示意图,b 电极是该燃料电池的_________(选“正极”或“负极”);
写出以石墨为电极的电池工作时负极的电极反应式
___________________________________。
- 7 -
答案
一、选择题(本题 16 个小题,每小题 3 分,共 48 分,只有一项是符合题目要求)
1-10 DBCDA BCDCB 11-16 DBCABA
二、非选择题(共 52 分,每空 2 分)
17、(8 分,每空 2 分)
(1)C5H12 3
(2)饱和碳酸钠溶液
(3)9.7%
18、(12 分,每空 2 分)
(1)
(2)O2+2H2O+4e-=4OH- 2NA
(3)NH4HCO3(化学式);NH4
++HCO3
-+2OH-=NH3↑+CO3
2-+2H2O
19、(8 分,每空 2 分)
(1) 取代反应(酯化反应)
(2)羧基
(3)
(4)
20、(12 分,每空 2 分)
(1)红棕色 C+4HNO3(浓) 4NO2↑+CO2↑+2H2O
(2)BaCO3
(3)安全瓶,防倒吸
(4)①B ②浓硝酸的分解
21、(12 分,每空 2 分)
(1)132.6kJ
- 8 -
(2)①0.15mol·L-1·min-1
②be
③>
(3)正极 CH3OH-6e-+H2O=CO2+6H+