- 330.50 KB
- 2021-04-13 发布
2018-2019学年吉林省白城市第一中学高一上学期第一次月考化学试题
可能用到的相对原子质量 H-1 C-12 N-14 O-16 Mg-24 Al-27
S-32 Cl-35.5 K-39 Fe-56 Cu-64 Zn-65
第︱卷 选择题
(每题只有一个选项符合题意1-10每题2分;11-20每题3分 共计50分)
1.现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如表所示,据此将乙二醇和丙三醇互相分离的最佳方法是
物质
分子式
熔点(℃)
沸点(℃)
密度(g·cm-3)
溶解性
乙二醇
C2H6O2
-11.5
198
1.11
易溶于水和酒精
丙三醇
C3H8O3
17.9
290
1.26
能跟水、酒精以任意比互溶
A.萃取法 B.结晶法 C.分液法 D.蒸馏法
2.下列离子检验的方法正确的是
A.向某溶液中加入硝酸银溶液,产生白色沉淀,说明原溶液中含有Cl-
B.向某溶液中加入氯化钡溶液,产生白色沉淀,说明原溶液中含有SO42-
C.向某溶液中加入氢氧化钠溶液,产生蓝色沉淀,说明原溶液中含有Cu2+
D.向某溶液中加入稀硫酸溶液,有气体生成,说明原溶液中含有CO32-
3、科学家最近合成一种新型的氧分子O4,关于O4的下列说法,正确的是
A、一个O4分子由两个O2分子构成 B、是一种单质
C、是一种化合物 D、是一种混合物
4.根据溶解度曲线,在80 ℃时将含有
等物质的量的硝酸钠和氯化钾混合溶液
恒温蒸发,首先析出的是
A.氯化钾 B.硝酸钠
C.氯化钠 D.硝酸钾
5、下列现象与胶体的性质无关的是
A、将盐卤或石膏加入豆浆,制成豆腐
B、一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
C、向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D、清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象
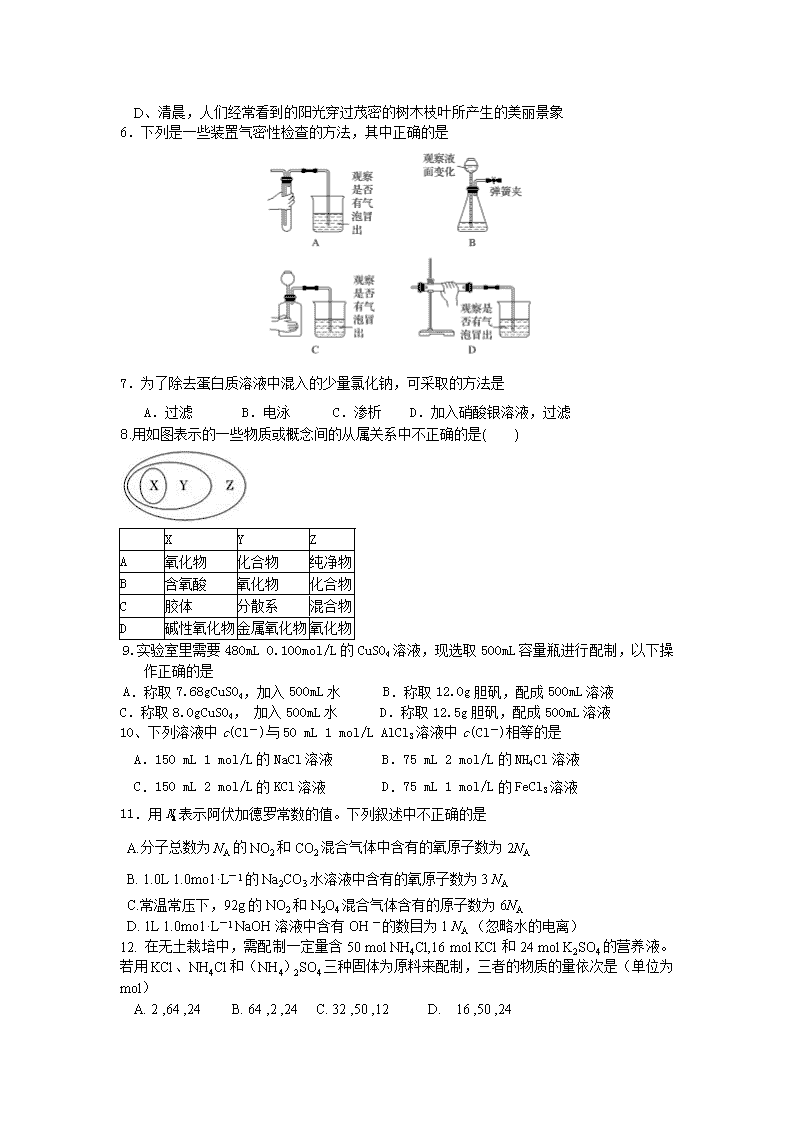
6.下列是一些装置气密性检查的方法,其中正确的是
7.为了除去蛋白质溶液中混入的少量氯化钠,可采取的方法是
A.过滤 B.电泳 C.渗析 D.加入硝酸银溶液,过滤
8.用如图表示的一些物质或概念间的从属关系中不正确的是( )
X
Y
Z
A
氧化物
化合物
纯净物
B
含氧酸
氧化物
化合物
C
胶体
分散系
混合物
D
碱性氧化物
金属氧化物
氧化物
9.实验室里需要480mL 0.100mol/L的CuSO4溶液,现选取500mL容量瓶进行配制,以下操作正确的是
A.称取7.68gCuSO4,加入500mL水 B.称取12.0g胆矾,配成500mL溶液
C.称取8.0gCuSO4, 加入500mL水 D.称取12.5g胆矾,配成500mL溶液
10、下列溶液中c(Cl-)与50 mL 1 mol/L AlCl3溶液中c(Cl-)相等的是
A.150 mL 1 mol/L的NaCl溶液 B.75 mL 2 mol/L的NH4Cl溶液
C.150 mL 2 mol/L的KCl溶液 D.75 mL 1 mol/L的FeCl3溶液
11.用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 1.0L 1.0mo1·L-1的Na2CO3水溶液中含有的氧原子数为3 NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 1L 1.0mo1·L-1 NaOH溶液中含有OH一的数目为1 NA (忽略水的电离)
12. 在无土栽培中,需配制一定量含50 mol NH4Cl,16 mol KCl和24 mol K2SO4的营养液。若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,三者的物质的量依次是(单位为mol)
A. 2 ,64 ,24 B. 64 ,2 ,24 C. 32 ,50 ,12 D. 16 ,50 ,24
13、使用容量瓶配制NaOH溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②NaOH溶解后未冷却立即将溶液转移到容量瓶并定容
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①③⑤⑥ B.①②⑤⑥ C.②③④⑥ D.③④⑤⑥
14、在托盘天平的两盘上,分别放有两个质量相同的烧杯,各盛有6mol/L HCl 100mL,使天平达到平衡。分别向两烧杯中加入不超过5g的镁和铝,若要使其充分反应后天平仍保持平衡,则加入的镁与铝的质量之比为
A. 1:1 B. 24:27 C. 12:9 D. 32:33
15.某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则表示的是
A.V L该气体的质量(以g为单位) B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位) D.1 L该气体中所含的分子数
16. 密度为0.91 g.cm-3的氨水,质量百分比浓度为25%(即质量分数为0.25),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
17.把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. 0.1(b-2a)mol / L B. 10(2a-b)mol /L
C. 10(b-a)mol / L D. 10(b-2a)mol /L
18.向量筒中注入水,仰视读数为a mL,倒出一部分水以后,俯视读数为b mL. ,则倒出水的实际体积为
A. (a-b) ml B. 大于(a-b) mL
C. 小于(a-b) mL D. 不能确定
19.己知FeO、Fe2O3、Fe3O4组成的混合物中,铁与氧的质量比为21:8,则混合物中FeO、Fe2O3、Fe3O4三种物质的物质的量之比为
A. 2:3:5 B. 1:1:33 C. 2:5:3 D. 1:2:3
20.t℃时,向xgKNO3不饱和溶液中,加入agKNO3或蒸发掉bg水恢复到t℃
,溶液均达到饱和,据此下列推论错误的是
A.在t℃时,KNO3的溶解度为100a/b g
B.若原溶液中溶质质量分数为,则x=2b
C.若原不饱和溶液蒸发掉2b g水,恢复到原温度,能析出2a gKNO3
D.在t℃时所配得的KNO3溶液中溶质质量分数≤
第‖卷非选择题(共50分)
21. (共10分)现有14.4g CO和CO2的混合气体,在标准状况下其体积为8.96L.
请回答下列问题:
(1)该混合气体的平均摩尔质量为_____.
(2)混合气体中碳原子的个数为_____(用NA表示阿伏加德罗常数的值).
(3)将混合气体依次通过如图2-3所示装置,最后收集在气球中(体积在标准状况下测定).
①气球收集到的气体的摩尔质量为_____.
②气球收集到的气体,电子总数为_____(用NA表示阿伏加德罗常数的值).
③气球的体积为_____L.
22. (14分)海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘化钾(即碘离子)的形式存在。实验室里从海藻中提取碘的流程如下图:
已知 (Cl2+2KI=2KCl+I2)
(1)实验室焙烧海带,需要下列仪器中的________(填字母)。
a.试管 b.烧杯c.坩埚 d.泥三角 e.三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③__________。
(3)提取碘的过程中,可选择的有机试剂是________。
A.苯、酒精 B.四氯化碳、苯 C.汽油、醋酸 D.汽油、酒精
(4)某小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,
下层液体呈______色;他们打开分液漏斗活塞,
却未见液体流下,原因可能是___________________ 。
(5)
从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处:
①________________________________________________;
②______________________________________________________;
③________________________________________________________。
(6)进行上述蒸馏操作时,使用水浴加热的目的_______________________,
最后晶态碘在________里聚集。
23.(14分)某学习小组用如图所示装置测定
锌铜合金中锌、铜的质量分数。
(1)实验前,先将锌铜合金在稀硫酸中浸泡片刻,
其目的是:___________________________________;
(2)实验操作步骤有:①将药品和水装入各仪器中
②连接好装置后,检查气密性
③记录C的液面位置
④将B中剩余固体过滤,洗涤,干燥,称重
⑤待B中不再有气体产生并恢复至室温后,
记录C的液面位置
⑥由A向B滴加足量的稀硫酸
上述实验的正确操作顺序是 ________________ (填序号);
记录C的液面位置时,除视线平视外,还应 _____________________
(3)B中发生反应的化学方程式为 _________________ ;
(4)若实验用锌铜合金的质量为a g,与稀硫酸充分反应后,
B中剩余固体的质量为bg,则锌的质量分数为 ____________ ;
(5)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将 ______ (填“偏大”“偏小”或“不受影响”)。
24.(12分)
在25℃,101 KPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
(1)若剩余气体的体积是15L,则原混合气体中CO的体积为_____ L
H2的体积为_______ L
(2)若剩余气体的体积为aL,则原CO和H2的混合气体的体积比是_____
(3)若剩余气体的体积为bL,则b的取值范围是__________
高一第一次月考化学试题答案
1 D 2 C 3 B 4 C 5 C 6 B 7 C 8 B 9 D 10 D
11 B 12 B 13 A 14 D 15 B 16 C 17 D 18 B 19 B 20 C
21共10分每个2分
(1)36g/mol (2)0.4 NA (3) ① 2.8g/mol ② 2.8 NA ③ 4.48
22(14分)
(1)cdef (1分) (2)过滤 (1分)萃取分液(1分) (3)B(2分)
(4)紫红(1分) 分液漏斗上口活塞小孔未与空气相通(2分)
(5)①缺石棉网(1分) ②温度计插到了液体中(1分)
③冷凝管进出水的方向颠倒(1分)
(6)使蒸馏烧瓶受热均匀,控制加热温度不至过高 (2分)蒸馏烧瓶(1分)
23(14分)
(1)除去合金表面的氧化膜(2分)
(2) ②①③⑥⑤④(3分) 使D和C的液面相平(2分)
(3)Zn + H2SO4 == ZnSO4+H2↑(2分)
(4)(a-b)/a×100% (3分)
(5) 偏小(2分)
24(12分)
(1)5 (2分) 5 (2分)
(2)(a-10):(20-a) (4分)
(3)10~20 (4分)